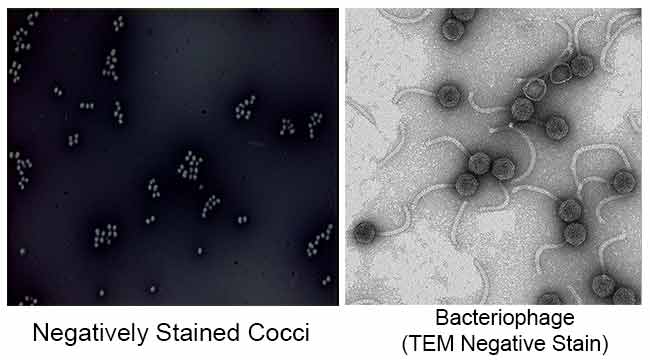
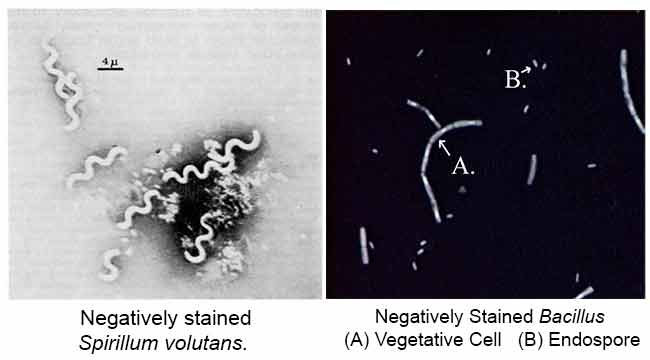
Het belangrijkste doel van negatieve kleuring is het bestuderen van de morfologische vorm, grootte en rangschikking van de moeilijk te bevlekken bacteriecellen. BV: Spirilla. Het kan ook worden gebruikt om cellen te bevlekken die te gevoelig zijn om te worden verhit.
Het wordt ook gebruikt om biologische monsters voor elektronenmicroscopie te bereiden. Het wordt gebruikt om virussen, bacteriën, bacteriële flagella, biologische membraanstructuren en proteã NEN of eiwitaggregaten te bekijken, die allen een lage elektron-het verspreiden macht hebben. Het wordt ook gebruikt voor de studie en identificatie van waterige lipidenaggregaten zoals lamellaire liposomen (le), omgekeerde sferische micellen (M) en omgekeerde hexagonale hii cilindrische (H) fasen door negatieve bevlekken transmissie elektronenmicroscopie.
principe van negatieve kleuring
negatieve kleuring vereist een zure kleurstof zoals Oost-Indische inkt of nigrosine.
Oost-Indische inkt of nigrosine is een zure vlek. Dit betekent dat de vlek gemakkelijk een waterstofion (proton) opgeeft en chromophore van de kleurstof negatief geladen wordt. Aangezien het oppervlak van de meeste bacteriële cellen negatief is geladen, stoot het celoppervlak de vlek af. Het glas van de dia zal vlekken, maar de bacteriële cellen niet. De bacteriën zullen verschijnen als heldere vlekken tegen een donkere achtergrond.
reagentia voor negatieve kleuring
Indiase inkt
nigrosine
nigrosine 100 g/ l, formaline 5 ml/L in water
procedure voor negatieve kleuring
1. Plaats een zeer kleine druppel (meer dan een lus vol, minder dan een vrije val van de druppelaar) nigrosine in de buurt van een uiteinde van een goed gereinigde en gevlamde glijbaan.
2. Verwijder een kleine hoeveelheid van de cultuur van de schuine kant met een inoculerende lus en verspreid deze in de vlek zonder de druppel te verspreiden.

3. Gebruik een andere schone dia om de druppel vlek die het organisme met behulp van de volgende techniek verspreiden.

4. Rust één uiteinde van de schone dia op het midden van de dia met de vlek. Kantel de schone dia naar de druppel vormen van een scherpe hoek en trek die glijden naar de druppel totdat het raakt de druppel en zorgt ervoor dat het te verspreiden langs de rand van de spreader dia. Handhaven van een kleine scherpe hoek tussen de dia ‘ s, duw de spreidingsdia naar het schone eind van de dia die bevlekt zijn en de daling achter de spreidingsdia slepen en een breed, zelfs, dun uitstrijkje veroorzaken.
 |
 |
5. Laat het uitstrijkje drogen zonder te verwarmen.

6. Focus een dun gebied onder Olie onderdompeling en observeer de Onbevlekte cellen omgeven door de grijze vlek.
procedure om te bekijken in Transmission Electron Microscope (tem)
- Houd een gecoate rasterflim zijde omhoog in een zelfspan tang.
- Maak een 1:1 mengsel van monster en negatieve vlek (bijv. 2% uranylacetaat of 2% natrium-of kaliumfosfotungstate, pH 7,4). Voeg 5µl toe. Kleinere deeltjes adsorberen sneller aan het netoppervlak dan grotere deeltjes.
Het monster gemengd met fixeermiddel kan ook aan het rooster worden toegevoegd voordat het vervolgens negatief wordt gekleurd. incubeer gedurende 30-90 seconden en verwijder de overtollige vloeistof met de gescheurde rand van een
stuk filtreerpapier. - aan de lucht drogen en onderzoeken in de TEM.
resultaten van negatieve kleuring