Identificeer de meest zure H
van een molecuul een methodische benadering werkt het beste. Simpel gezegd, moet u het molecuul voor zure functionele groepen scannen, en dan de reactiviteit van deze groepen rangschikken. De meest zure functionele groep houdt meestal de meest zure H in het gehele molecuul.
“scannen en rang” klinkt eenvoudig, maar het verbergt een aantal problemen die hieronder worden uitgewerkt.
Scan een molecuul voor bekende zure functionele groepen
zure protonen worden gewoonlijk gebonden aan O of N. Daarom is de eerste stap om te zoeken naar alle oh en NH bindingen.
echter, als u OH-en NH-bindingen lokaliseert, moet u beslissen of deze gebonden atomen moeten worden samengevoegd in een functionele groep met naburige atomen.
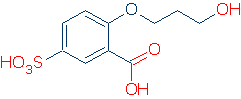
de enige handige methode om een functionele groep te identificeren is om er al een aantal te kennen. Bijvoorbeeld, als u weet dat ROH, RCO2H, en RSO3H gemeenschappelijke zure functionele groepen zijn, zult u geen moeite hebben om zure groepen in de volgende molecule te vinden (de correcte groepen zijn in rood gemarkeerd).
rangschikken OH en NH zuurtegraad afzonderlijk
de pKa-waarden van gemeenschappelijke oh en NH zuren overspannen Grote bereiken en hun bereiken overlappen elkaar. Rangschikking verloopt sneller als je de oh en NH-zuren afzonderlijk rangschikt en vervolgens de beste kandidaten in elke categorie vergelijkt.
de meest geschikte methode voor het rangschikken van zure groepen is om hun karakteristieke pKa-waarden al te kennen. Als u deze waarden kent voor alle zure groepen in uw molecuul, dan bevat de groep met de laagste pKa de meest zure H. geval gesloten.
Als u geen PKA-waarden voor alle zuurgroepen herinnert, kunnen enkele algemene principes u leiden.
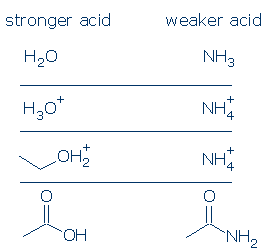
#1 belang-positief geladen zuren zijn sterker dan neutrale zuren. Negatief geladen zuren zijn zelden zuur. Als je pKa-waarden van gewone OH-zuren vergelijkt, zul je zien dat ROH2+ – zuren (waaronder H3O+ en R2OH+) aanzienlijk sterker zijn dan neutrale zuren, zoals RCO2H, PhOH en ROH. De enige neutrale zuren die sterker zijn dan ROH2+ zijn H2SO4 en bepaalde andere RSO3H.
de formele ladingsregel geldt nog sterker voor NH-zuren. Het verschil in pKa tussen H3O+ en H2O is 18 eenheden, terwijl het verschil in pKa tussen NH4 + en NH3 een gigantische 26 eenheden is.
#2 belang-zoek naar activerende groepen, waaronder RSO2, RC = O, en Ph. de volgende grafiek laat zien hoe elke groep atomen een OH-zuur activeert (PKA-waarden variëren van 16 tot -2):
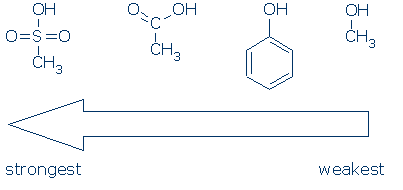
CH3 wordt beschouwd als een spectatorgroep waar het ook voorkomt in deze moleculen. Het is niet-polair en oefent geen significant veld-inductief effect uit, en het is niet in staat om lading te delocaliseren. Bijgevolg is het mogelijk om CH3 te vervangen door andere groepen toeschouwers (bijvoorbeeld H en andere R) zonder de reactiviteit veel te beïnvloeden.
twee extra punten moeten worden gemaakt met betrekking tot activerende groepen.
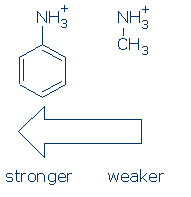
eerst hebben de groepen een vergelijkbaar effect op NH-zuren (en de activerende sequentie is hetzelfde: RSO2 > RC=O > Ph). Als het gebeurt, hoeft u alleen maar het effect van Ph op NH + te leren voor deze cursus:
ten tweede moeten de activerende groepen direct verbonden zijn met de OH (of NH) groep om het te activeren. De volgende verbindingen hebben vergelijkbare PKA-waarden omdat de activerende groepen niet direct gebonden zijn aan OH: CH3C (=O)CH2OH, PhCH2OH en CH3CH2OH.
#3 belang – alle dingen zijn gelijk, een OH zuur is zuurder dan een NH zuur. Dit principe kan zeer nuttig zijn als het goed wordt gebruikt. Mijn zorg is dat je begrijpt wat er wordt bedoeld met “alle dingen gelijk zijn.”Dit betekent dat O en N dezelfde formele lading moeten hebben (item #1) en gebonden moeten zijn aan dezelfde activerende groep (item #2). Verschillen in groepen toeschouwers doen er echter niet toe.
enkele geldige vergelijkingen zijn:
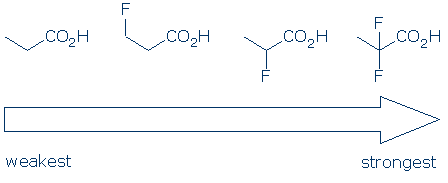
#4 belang – binnen een functionele groepscategorie, gebruik substituente effecten om zuren te vergelijken. Elektronegatieve substituenten verbeteren meestal de zuurgraad van een functionele groep door een combinatie van veld-en inductieve effecten. Deze effecten worden versterkt wanneer 1) de substituent zich dichter bij de zure groep bevindt, en 2) er meerdere substituenten zijn. Gezien deze principes verwachten we dat de zuurgraad van deze carbonzuren deze trend volgt: