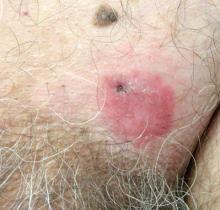
een 70-jarige man vertoonde een niet-pruritische erythemateuze schilferige plaque in het Left suprapubic region van 6 maanden die niet had gereageerd op terbinafine crème 1% na 1 maand behandeling van vermoede tinea cruris. Zijn medische geschiedenis was opmerkelijk voor Hypertensie, hyperlipidemie, chronische obstructieve longziekte, goedaardige prostaathyperplasie, een abdominale aorta aneurysma, alcoholafhankelijkheid, tabaksgebruik stoornis, en onbedoeld gewichtsverlies van 15 pond in het afgelopen jaar.
De diagnose: Extramammary Paget Disease
een biopsie van de plaque toonde een intra-epidermale proliferatie aan van grote cellen met overvloedig duidelijk cytoplasma en grote vesiculaire kernen verspreid over de epidermis (figuur 1). De neoplastische cellen gekleurd positief voor zowel periodieke zuur-Schiff vlek (Figuur 2) en CK7 (Figuur 3). Chemie – en leverfunctiepanel, urineanalyse, carcinoebryonische antigeenspiegels en prostaatspecifieke antigeenspiegels lagen binnen het referentiebereik. Een volledige bloedceltelling onthulde milde megaloblastische bloedarmoede. Daaropvolgende computertomografie van de borst, buik, en bekken onthulde een abdominale aorta aneurysma en prostaatvergroting zonder enig bewijs van potentiële malignancies. Colonoscopie onthulde meerdere hyperplastische poliepen en een tubulair adenoom. Cystoscopie was normaal, behalve bewijs van prostaatvergroting. Cytologie van de Urine was onopvallend. De patiënt werd doorverwezen voor excisie van de laesie met Mohs micrografische chirurgie. Follow-up werd aanbevolen om de 3 maanden gedurende de eerste 2 jaar na de operatie en om de 6 maanden daarna om te controleren op recidief of secundaire neoplasmata.
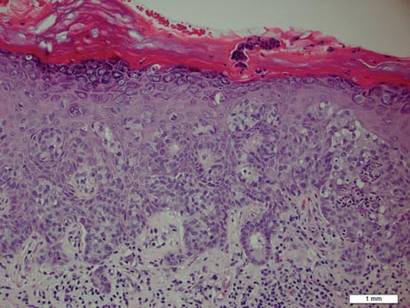
figuur 1. Intra-epidermale proliferatie van grote cellen met overvloedig duidelijk cytoplasma en grote vesiculaire kernen verspreid over de epidermis als individuele cellen en als aggregaten van verschillende grootte van cellen (h&E, oorspronkelijke vergroting ×200). (Referentiebalk geeft 1 mm aan.)
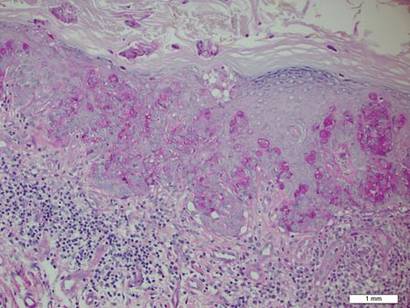
Figuur 2. Korrelig cytoplasma was positief op periodieke zuur-Schiff kleuring (oorspronkelijke vergroting ×200). (Referentiebalk geeft 1 mm aan.)
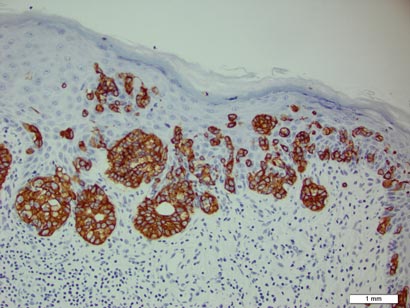
Figuur 3. Neoplastische Paget-cellen waren karakteristiek positief op kleuring voor CK7 (oorspronkelijke vergroting ×200). (Referentiestaaf geeft 1 mm aan) Sir James Paget beschreef voor het eerst de borstziekte van de tepel in 1874 in zijn rapport van 15 vrouwen met huiderupties van de tepel en tepelhof en vervolgens carcinoom van de onderliggende Borst.1 Paget beschreef ook een patiënt met een vergelijkbare eruptie op de eikel en Crocker2 beschreef extramammary Paget disease (EMPD) van het scrotum en de penis in 1889. Het principe verschil tussen mammacy Paget disease en EMPD is de anatomische locatie.
Extramammary Paget disease is een zeldzame aandoening die typisch patiënten in de leeftijd van 50 tot 80 jaar treft en komt vaker voor bij vrouwen en blanke rassen.3 de ziekte van Extramammary Paget richt zich vaak op cutane plaatsen die rijk zijn aan apocriene klieren. De meest getroffen plaats is de vulva gevolgd door perineale, perianale, scrotale en penis huid. Minder vaak, de oksels, billen, dijen, oogleden, en externe auditieve kanalen kunnen worden beïnvloed.4
patiënten met EMPD vertonen doorgaans goed afgebakende, niet-oplossende, erythemateuze en eczemateuze plaques die gepaard kunnen gaan met korstvorming, schilfering, papillomateuze uitwassen, lichenificatie, ulceratie of bloeding. Het gemeenschappelijkste symptoom is pruritus, gevolgd door het branden, irritatie, pijn, en tederheid.5 tien procent van de patiënten is asymptomatisch. Het gemiddelde interval tussen het begin van de symptomen en de diagnose is 2 jaar.5
histopathologie toont diffuse infiltrerende, onregelmatige, neoplastische pagetcellen in de epidermis die groot en vacuolated zijn met overvloedig bleekblauw cytoplasma en grote vesiculaire kernen, die centraal of zijdelings gecomprimeerd kunnen zijn. De cellen kunnen afzonderlijk of in groepen als bundels, nesten, of klierpatronen binnen de onderepidermis, rete richels, en adnexal structuren worden verdeeld. Hyperkeratosis, acanthosis, en parakeratosis kunnen ook aanwezig zijn. Paget cellen kleuring voor immunohistochemische markers van apocrine en eccrine afleiding met inbegrip van laag-moleculaire gewicht cytokeratines, bruto cystic disease fluid protein 15, periodieke zuur-Schiff kleuring, en carcinoebryonic antigeen.5 Perrotto et al6 bestudeerden 98 specimens van 61 patiënten en vonden dat CK7 positief was in alle EMPD-specimens, terwijl CK20 en Gross cystic disease fluid protein 15 positief waren in grote subgroepen van zowel primaire als secundaire EMPD. Gevallen van EMPD secundair aan anorectaal adenocarcinoom waren grotendeels ErbB2 (voorheen HER2/neu) negatief en CDX2 positief.6
diagnose van EMPD moet worden gevolgd door een grondig onderzoek naar onderliggende carcinomen. In een overzicht van 197 gevallen van EMPD had 24% van de patiënten met EMPD een geassocieerd onderliggend in situ of invasief adnexaal apocrien carcinoom, dat in verband werd gebracht met een hoger sterftecijfer dan bij patiënten zonder deze onderliggende maligniteit. Bovendien had 12% van de EMPD-patiënten een geassocieerde onderliggende interne maligniteit.7 Deze maligniteiten kunnen carcinomen van de urethra, blaas, vagina, baarmoederhals, endometrium, prostaat, colon, en rectum omvatten. Perianale EMPD heeft een hogere frequentie van geassocieerde maligniteiten dan vulvaire EMPD.De locatie van EMPD is gerelateerd aan de locatie van de onderliggende maligniteit; perianale EMPD wordt bijvoorbeeld geassocieerd met colorectale adenocarcinomen en EMPD van de penis, het scrotum en de lies wordt geassocieerd met urogenitale maligniteiten. Onderzoeken naar geassocieerde maligniteiten bij patiënten met EMPD kunnen bestaan uit echografie van het bekken en/of beeldvorming met magnetische resonantie, hysteroscopie, colonoscopie, sigmoidoscopie, cystoscopie, intraveneus pyelogram, mammogram en/of radiografie van de borst.