John E. Cunningham
INTRODUCCIÓN
La pseudoartrosis, o no unión, es una complicación demasiado común y costosa de la cirugía de fusión espinal, y el costo por AVAC (año de vida ajustado por calidad) ganado se estima en aproximadamente US 1 118,945.1 diferentes técnicas quirúrgicas y poblaciones de pacientes.2
La pseudoartrosis se define generalmente como el fracaso de la unión ósea entre dos vértebras dentro de los 12 meses posteriores a la cirugía.3 Hasta que se logre la fusión ósea sólida, el cirujano no debe considerar que su paciente ha alcanzado un punto final quirúrgico, independientemente de la indicación inicial para la cirugía de fusión.
La prevención de la pseudoartrosis puede ser difícil, al igual que el diagnóstico y el tratamiento. Parte de la dificultad de la prevención pueden ser los factores de riesgo del paciente que a menudo no son modificables a corto plazo. Se recomienda a los cirujanos que tomen nota de estos factores de riesgo y modifiquen su tratamiento quirúrgico para mejorar esos riesgos lo mejor que puedan. Ocasionalmente, esto puede incluir retrasar o incluso cancelar la intervención quirúrgica si el riesgo de pseudoartrosis y el mal resultado resultante superan cualquier beneficio previsto de la cirugía.
La presentación de la pseudoartrosis a menudo incluye dolor, que generalmente es de naturaleza central y cuyo inicio puede ser muchos meses después de la operación. La investigación y el diagnóstico más comúnmente implican una exploración por TC de corte fino, y siempre se debe incluir la consideración de la infección concomitante. El tratamiento más a menudo implica cirugía de revisión que emplea una multitud de técnicas.
FACTORES DE RIESGO
Los factores del paciente desempeñan un papel importante con respecto al riesgo de pseudoartrosis. Fumar es uno de los factores de riesgo mejor estudiados.4,5 Brown et al., realizó un estudio aleatorizado de 100 pacientes sometidos a fusión de dos niveles sin instrumentos de L4 al sacro.6 Los no fumadores tenían una tasa de pseudoartrosis del 8%, mientras que los fumadores regulares tenían una tasa cinco veces mayor, del 40%. Un estudio más reciente examinó el impacto de fumar en presencia de instrumentación de tornillo pedicular, pero sin dispositivos intersomáticos.7 Para las fusiones de un solo nivel, no encontraron diferencias en las tasas de fusión, pero para las fusiones de dos niveles, la pseudoartrosis fue tres veces mayor (29 vs.11%).
Otros factores del paciente que influyen en la tasa de unión son aquellos que no deben sorprender a un cirujano ortopédico, ya que son similares a los de las no uniones generales. Estos incluyen la edad, el uso de esteroides y AINE, diabetes, desnutrición y cirugía previa.8,9 La radiación perioperatoria también disminuye las tasas de fusión,10 lo cual debe tenerse en cuenta al tratar a pacientes con tumores.
Desde el punto de vista quirúrgico, el número de niveles aumenta el riesgo de pseudoartrosis, al igual que el uso de fijación no rígida.9,11 La instrumentación de cualquier tipo aumenta la velocidad de fusión con respecto a las fusiones sin instrumentos.12 En orden de tasas de fusión, la ubicación de fusión circunferencial da la más alta (intersomática y posterolateral), seguida de intersomática posterior, intersomática anterior y luego posterolateral.11 Existe evidencia de que los dispositivos intersomáticos de titanio se fusionan más rápido y con más frecuencia que los fabricados con PEEK.13-15
Osteotomía por sustracción de pedículos
La operación de osteotomía por sustracción de pedículos (PSO) se está realizando en número creciente debido a nuestra mayor apreciación de la malalineación sagital y al envejecimiento de nuestra población.16 Una de las principales complicaciones es la pseudoartrosis, que ocurre en aproximadamente el 10% de los pacientes.17 La pseudoartrosis ocurre con mayor frecuencia a nivel de la osteotomía, y los factores de riesgo incluyen la realización de la operación para el manejo de una pseudoartrosis preexistente, radiación preoperatoria, la presencia de un trastorno neurológico o inflamatorio y la falta de una fusión intersomática directamente encima de la osteotomía. Esta última observación está respaldada por estudios de cadáveres.18 Parece que las jaulas intersomáticas mejoran las tasas de fusión al aumentar la rigidez de la estructura. También es por esta razón que los autores optan por agregar una tercera varilla a los constructos de PSO, de un nivel por encima a un nivel por debajo del sitio de osteotomía utilizando conectores de lado a lado y una varilla de cromo-cobalto, similar a la técnica descrita por Hyun et al.19
Cirugía de Deformidad Espinal
En un estudio de operaciones de deformidad que incluyeron el sacro, la tasa de seudartrosis fue del 24%.20 Todas las pseudoartrosis se detectaron antes de los cuatro años posteriores a la cirugía en un promedio de 27 meses, y se produjeron en la unión toracolumbar o en la unión lumbosacra. Los factores de riesgo identificados fueron cifosis toracolumbar y abordaje toracoabdominal (para seudartrosis toracolumbar), artrosis de cadera y balance sagital positivo ≥ 5 cm (para seudartrosis lumbosacra) y edad > 55. Como era de esperar, los pacientes con pseudoartrosis tuvieron puntuaciones más bajas de la Sociedad de Investigación de Escoliosis (SRS) que aquellos con una fusión sólida (71 vs.90/120).
PRESENTACIÓN
La pseudoartrosis puede presentarse de tres maneras diferentes. El paciente puede ser asintomático y tener buena función, puede ser sintomático, o puede tener una pseudoartrosis asociada con otra entidad patológica como una infección.
Puntuaciones de Resultados funcionales
No está claro por qué muchos pacientes con pseudoartrosis permanecen asintomáticos y tienen buenos resultados funcionales. Un pequeño estudio de 1968 comparó los resultados de pacientes con fusión de sólidos vs.pseudoartrosis y encontró poca diferencia.21 La descripción de la fusión se da como Hibbs o tipo «H», y se puede suponer, por lo tanto, que los autores estaban realizando fusiones sin instrumentos. Un estudio más moderno de fusiones sin instrumentos no encontró los mismos resultados, con solo el 56% de los pacientes con pseudoartrosis logrando resultados aceptables en comparación con el 86% de los pacientes con una fusión sólida.22
Al examinar los estudios de fusiones instrumentadas, hay evidencia mixta de la correlación entre la unión sólida y el buen resultado. Una revisión de Resnick et al. concluyó que, » la mayoría de la evidencia médica de clase III sugiere que la fusión radiográfica exitosa se asocia con mejores resultados clínicos.»23 Algunos de estos estudios fueron aleatorizados, pero todavía se clasificaron como de Clase III debido a las altas tasas de cruce.
En un examen de pacientes con deformidad consecutiva en una institución, todos los pacientes con seudartrosis comprobada al año o más no mejoraron su puntuación en el SRS o en el Índice de Discapacidad de Oswestry (ODI).24 De hecho, la falta de mejoría en estas puntuaciones fue más precisa para detectar pseudoartrosis que las radiografías simples. Esto también se observó en el estudio de escoliosis discutido anteriormente.20 Este hallazgo lleva a los autores a concluir que la puntuación de los resultados funcionales es esencial para monitorear a los pacientes con deformidad en el postoperatorio y debe servir como desencadenante para una investigación adicional de la pseudoartrosis.
Pseudartrosis asintomática
La detección de pseudartrosis en el paciente asintomático suele ser el resultado de la vigilancia por parte del cirujano y requiere una consideración interesante. Por ejemplo, si un paciente tiene una pseudoartrosis y, sin embargo, es asintomático y funciona bien, ¿se puede ganar algo exponiéndolo a la radiación para encontrar una anomalía que probablemente no requiera intervención quirúrgica? ¿En qué circunstancias la detección de una pseudoartrosis va a cambiar el manejo del cirujano de un paciente asintomático? Sería razonable que después de cualquier procedimiento multinivel u osteotomía, la detección y el tratamiento tempranos de una seudartrosis asintomática puedan prevenir complicaciones catastróficas en el futuro, por lo que la vigilancia es razonable. Esto se puede hacer de manera efectiva y eficiente con sistemas de puntuación estándar. Sin embargo, después de un procedimiento de un solo nivel, es poco probable que haya alguna complicación importante en el futuro, incluso si no se uniera, por lo que el cribado radiológico es posiblemente menos importante.
Pseudoartrosis sintomática
En el caso de pseudoartrosis sintomática, la presentación suele ser de empeoramiento del dolor de espalda axial. El dolor puede ser un empeoramiento del dolor original de la operación («nunca mejoró») o puede ser de nueva aparición. Los pacientes con escoliosis pueden quejarse de un empeoramiento de la deformidad, aunque esto no es común. En el caso de la espondilitis anquilosante, los pacientes pueden ser sensibles a su horizonte visual. Los síntomas neurológicos son inusuales a menos que la deformidad segmentaria sea considerable.
Pseudoartrosis concomitante
El diagnóstico concomitante más probable es la infección. Un historial de fiebre, regreso no planificado al quirófano, terapia antibiótica a largo plazo y la de una herida de descarga son fuertemente sugestivos de infección. La pérdida de peso y el malestar también pueden acompañar la presentación. Se debe examinar cualquier otro portal de infección.
INVESTIGACIÓN
La investigación de una sospecha de pseudoartrosis debe tener en cuenta los diagnósticos diferenciales o concomitantes probables. Aunque es difícil de interpretar inicialmente, se deben examinar la PCR y la VSG, al igual que cualquier otra sangre que sugiera infección. Se debe inspeccionar la herida y documentar cualquier hinchazón o acumulación de tejidos blandos. Cualquier colección de fluidos debe ser muestreada y enviada para microscopía, cultivo y pruebas de sensibilidad. Incluso las investigaciones preoperatorias pueden pasar por alto infecciones de bajo grado, por lo que el cirujano debe estar preparado en caso de que se encuentre líquido purulento al revisarlo.
Estudios de imágenes
Análisis estadístico
Cualquier discusión sobre estudios de imágenes, o cualquier otra prueba de diagnóstico para el caso, debe incluir una apreciación de la sensibilidad y especificidad, y valores de 𝜅 (kappa). Cualquier cirujano debe estar familiarizado con estos términos y cómo se pueden usar para guiar nuestra toma de decisiones. A los efectos de leer el texto a continuación, las pruebas se analizan como tratando de detectar una fusión. Por lo tanto, la sensibilidad se refiere a la posibilidad de identificar correctamente una fusión, mientras que la especificidad se refiere a la posibilidad de identificar correctamente una pseudoartrosis.
Una prueba de baja sensibilidad puede «fallar» una fusión sólida y puede alentar al cirujano a realizar procedimientos innecesarios en un intento de reparar una pseudoartrosis ostensible, que en realidad es sólida. Una prueba de baja especificidad, por otro lado, puede «perder» una pseudoartrosis y dejar al cirujano y al paciente la creencia de que la fusión es sólida, cuando en realidad no lo es.
El valor kappa, o coeficiente kappa de Cohen, es una medida de la concordancia entre observadores y varía entre 0 (sin concordancia, o concordancia solo por casualidad) y 1 (concordancia perfecta). Un valor de 0,41–0.60 se considera que muestra un acuerdo moderado, y un acuerdo sustancial de 0,61 a 0,80. Los valores superiores a 0,81 se consideran de acuerdo «casi perfecto» en los campos biomédicos.25 La importancia práctica de esto es que incluso si una prueba tiene una alta sensibilidad y especificidad, un valor kappa bajo debe indicar al cirujano que el resultado real puede depender en gran medida del observador. Una forma de evitar esto puede ser obtener consenso mediante la presentación de los resultados a múltiples especialistas.
Radiografías
Radiografías simples
Dos de los mejores estudios de radiografías simples son los de Brodsky y Kant.26,27 Sus resultados fueron bastante similares. La correlación entre las radiografías estáticas simples y la exploración quirúrgica fue de 64-68%, con una sensibilidad de 85-89% pero una especificidad baja de 60-62%. Si una radiografía demuestra una fusión sólida, en otras palabras, es probable que sea sólida, pero si sugiere pseudoartrosis, entonces no se puede confiar en ella. El tiempo desde la cirugía hasta la detección de una pseudoartrosis por rayos X también es bastante largo, con una media de 3,5 años.20
Otro problema es la gran variabilidad en la interpretación de los rayos X, tanto entre observadores como intraobservadores. En un estudio en el que las radiografías fueron evaluadas por dos cirujanos y dos radiólogos, el ERS = 0,4–0,7, lo que indica una correlación deficiente. Por lo tanto, a pesar de la naturaleza relativamente barata de los rayos X simples y su disponibilidad, los autores no los recomiendan para la evaluación de la fusión sólida.
Rayos X dinámicos o de flexión
Las películas dinámicas o de flexión, también conocidas como estudios de extensión de flexión, funcionan de manera similar a los rayos X simples cuando se investiga la pseudoartrosis. En el mismo estudio de Brodsky et al. mencionado anteriormente, se encontró que, si bien la ausencia de movimiento en estos estudios se correlacionó bien con la fusión sólida, el movimiento no necesariamente indica pseudoartrosis.26
Tomografía Computarizada (TC)
En el estudio ya comentado de Brodsky et al., Se encontró que la tomografía computarizada solo tenía una sensibilidad del 63%, una especificidad del 86%, un valor predictivo positivo del 72% y un valor predictivo negativo del 81%. Estos resultados no fueron dramáticamente diferentes de los rayos X simples, sin embargo, uno debe tener en cuenta que este estudio, y muchos similares, se realizaron a fines de la década de 1980. Por lo tanto, no debe sorprender que los estudios más modernos, con escáneres helicoidales de múltiples cortes más modernos, hayan mostrado resultados mucho mejores. Desafortunadamente, no muchos han comparado las imágenes con la exploración quirúrgica.
Fusiones posterolaterales
En dos estudios más recientes se compararon los hallazgos de la tomografía computarizada con la exploración quirúrgica. En su artículo de 2007,28 Carreon et al. se utilizaron tomografías computarizadas de corte axial de 1 mm impresas en película y se evaluaron por tres cirujanos de columna vertebral. Curiosamente, documentaron la fusión a través de la articulación facetaria, así como la fusión en las canaletas posterolaterales. Cuando se observó fusión en ambas facetas y en ambos canales posterolaterales, la probabilidad de una fusión sólida en la exploración fue del 96%. Si se veía solo en las canaletas posterolaterales, entonces esto se redujo al 89%, y finalmente si solo se veía fusión a través de las articulaciones facetarias, entonces la probabilidad de ver una fusión sólida en la exploración era del 74%. Sin embargo, la ausencia de fusión a través de ambas articulaciones facetarias o de una canaleta posterolateral no predijo de forma fiable la pseudoartrosis en la exploración.
Fusiones intersomáticas lumbares anteriores (ALIF)
En el segundo artículo, mirando las fusiones intersomáticas lumbares anteriores utilizando jaulas metálicas, Carreon et al., 29 se utilizó un protocolo similar. Aunque hubo una variabilidad sustancial entre los observadores, cuando se obtuvo el consenso, la tomografía computarizada tuvo una sensibilidad del 93% y una especificidad del 46% para la fusión. El signo centinela anterior30 solo tuvo una sensibilidad del 20% y una especificidad del 92% para detectar una fusión, mientras que el signo centinela posterior demostró ser más preciso, con una sensibilidad del 67% y una especificidad del 79%. La ausencia de un signo centinela anterior es una buena prueba para la pseudoartrosis.
Fusiones Intersomáticas Lumbares Posteriores / Transforaminales (PLIF/TLIF)
La evaluación de la fusión intersomática a menudo es problemática. El artefacto a menudo puede interferir con las imágenes por TAC, particularmente cuando se realiza en máquinas viejas, y los marcadores de tantalio dentro de las jaulas de PEEK o fibra de carbono a menudo pueden dejar un artefacto dramático (Fig. 4-1). Las modernas máquinas helicoidales de múltiples cortes con algoritmos de eliminación de artefactos más sofisticados han facilitado la tarea, y las reconstrucciones de planos coronales son excelentes para visualizar la masa de fusión entre cuerpos.
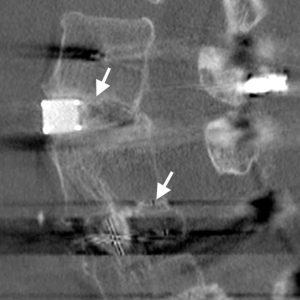
Shah et al.31 realizaron tomografías computarizadas a pacientes a los 6 meses de postoperatorio que se habían sometido a un PLIF utilizando jaulas de titanio, donde el único injerto óseo se empaquetaba dentro de las jaulas. Describió la trabeculación ósea de puente tanto dentro de las jaulas, como fuera de las jaulas donde no se había embalado ningún injerto óseo. Se observaron similitudes con el signo centinela. También encontró que la tomografía computarizada era mucho más sensible a la hora de determinar la presencia o ausencia de una interfaz de jaula de placa terminal radiolúcida que la radiografía, con un acuerdo muy alto entre los observadores. Fogel et al., 32 por otro lado, encontró que había poca diferencia entre las tomografías computarizadas y las radiografías al evaluar la fusión después de PLIF. Sin embargo, la dificultad con el artículo es que solo se encontraron cuatro casos de pseudoartrosis en la exploración de los 172 niveles explorados quirúrgicamente. Con una tasa de pseudoartrosis tan baja de 2.3%, los cálculos de sensibilidad y especificidad pueden verse fuertemente influenciados por cambios relativamente pequeños en la detección.
Un artículo muy útil de Kanemura et al.33 cambios radiográficos rastreados a lo largo del tiempo. Examinaron a 153 pacientes hasta cinco años después de la cirugía después de la PLIF utilizando injerto óseo local y cresta ilíaca. Encontraron que el movimiento ≥ 5° en los rayos X dinámicos era máximo a un año, pero luego disminuía constantemente con el tiempo. Del mismo modo, encontraron que, utilizando rayos X y tomografía computarizada, las zonas radiolúcidas alrededor de los tornillos pediculares también eran máximas a un año, pero luego se resolvieron sin intervención quirúrgica a los tres o cuatro años. El hueso puente anterior comenzó a formarse a los tres meses y luego continuó. El volumen del injerto óseo intersomático tendió a disminuir a los 6 meses, pero luego volvió a aumentar después de dos o tres años.
Con tantos cambios asociados con la pseudartrosis presentes en el postoperatorio de 6 a 12 meses, este artículo desafía al cirujano a retrasar la intervención quirúrgica para la pseudartrosis hasta que hayan pasado al menos dos o tres años, ya que muchos cambios se resolverán sin intervención. ¿Hay alguno de los cambios asociados con el diagnóstico final de pseudoartrosis? El único predictor encontrado fue la presencia de una zona radiolúcida alrededor de la jaula intersomática de más de 1 mm a los 12 y 18 meses. Este fue un predictor independiente, y se asoció con hundimiento, movimiento y disminución del injerto óseo intersomático.
Imágenes por resonancia magnética
Aunque ha habido algunos estudios que analizan la precisión de la RMN34,35,no se ha comparado favorablemente con la TC o la exploración quirúrgica. Puede proporcionar al cirujano información sobre los cambios modicos presentes en el espacio del disco fusionado, pero no se ha demostrado que esto se correlacione de manera confiable con la fusión o la pseudoartrosis.
El análisis estereofotogramétrico de Roentgen (ASR)
El ASR es una técnica mediante la cual los marcadores de tántalo se incrustan dentro de las vértebras óseas en el momento de la cirugía. Luego se toman imágenes estandarizadas de las perlas en el período postoperatorio, y el movimiento se puede medir con precisión.36 Esta técnica sufre un problema similar al de los rayos X dinámicos, en que el movimiento, o la falta de éste, no se correlaciona necesariamente con la pseudoartrosis. Por ejemplo, de acuerdo con RSA, es posible que no haya movimiento a través de un segmento inmediatamente después de la cirugía, pero obviamente aún no se ha establecido una fusión.37 Se utiliza solo con fines de investigación, y la correlación clínica con la fusión debe hacerse con cuidado.
Medicina nuclear
La exploración ósea de tecnecio-99m a menudo se usa para evaluar la actividad del hueso alrededor de una masa de fusión. Se cree que se correlaciona con la fusión, ya que el escaneo es «frío». Sin embargo, no hay pruebas de su utilidad. En comparación con la exploración quirúrgica, aunque era específica (93%), carecía de sensibilidad (50%) y solo tenía un valor predictivo positivo del 40% al buscar pseudoartrosis.Se encontraron 38 resultados similares al observar a pacientes con escoliosis.39 Se cree que el problema principal es que la técnica es incapaz de diferenciar entre pseudoartrosis establecida y masa de fusión inmadura.
Ultrasonido
El uso de ultrasonido ha sido evaluado en un estudio pequeño, comparando la apariencia de las estructuras posteriores con la exploración quirúrgica.40 Aunque parecía prometedor, su capacidad para evaluar la masa de fusión anterior es limitada. No se han realizado más estudios.
CLASIFICACIÓN
Fusión posterolateral
Heggeness y Esses fueron los primeros en clasificar morfológicamente diferentes tipos de pseudoartrosis de fusiones posterolaterales (Tabla 4-1).41 También describieron el «signo de teja» que se ve comúnmente en el tipo de seudartrosis de teja, en el que una astilla de hueso que se ve flotando detrás de los elementos posteriores cuando se mira un corte axial de TC. Esta clasificación es útil porque sugiere la causa de la pseudoartrosis.
| Tipo | Descripción |
| Atrófica | la atrofia y la reabsorción de la fusión de la masa ósea |
| Transversal | masa ósea adecuada, pero una discontinuidad horizontal persiste |
| Teja | variación de la transversal donde la discontinuidad es oblicua |
| Complejo | la presencia de múltiples defectos de fusión |
Lenke et al.42 describió una clasificación más cualitativa de la masa de fusión posterolateral, que iba de A «definitivamente sólida» a D «definitivamente no sólida» (Tabla 4-2). Si bien esto puede ser útil para describir las fusiones, sí brinda asistencia al cirujano para diagnosticar o tratar la complicación.
| Tipo | Taquigrafía | Descripción |
| A | definitivamente sólido | masas sólidas de fusión bilaterales trabeculadas grandes |
| B | posiblemente sólido | masa de fusión unilateral grande con masa de fusión contralateral pequeña |
| C | probablemente no sólida | masas de fusión pequeñas y finas bilateralmente |
| D | definitivamente no sólido | reabsorción de injerto bilateral o masa de fusión con pseudartrosis bilateral obvia |
Fusión intersomática
Brantigan y Steffee describieron por primera vez una clasificación de fusión intersomática a través de su jaula de fibra de carbono.43 Posteriormente modificada por Fraser, se conoce generalmente como la clasificación BSF (Brantigan, Steffee, Fraser) (Tabla 4-3).32,44 La pseudoartrosis se evalúa mediante tomografía computarizada y se clasifica como BSF – 1 donde hay signos macroscópicos de movimiento (Fig. 4-2), o BSF-2 donde hay una lucencia horizontal a través del espacio intersomático (Fig. 4-3). Esta última se conoce generalmente como»pseudoartrosis bloqueada». En cuanto a la fusión, consideraban que la fusión era sólida si se veía que el hueso crecía a través de una de las jaulas PLIF, incluso si la otra tenía lucencia a través de ella.
| Descripción | |
| BSF-1 | Radiográfica la pseudoartrosis es indicado por
|
| BSF-2 | Radiográfica bloqueado la pseudoartrosis es indicado por la lucidez visible en el centro de las jaulas con hueso sólido creciendo en la jaula desde cada placa terminal vertebral. |
| BSF-3 | Fusión radiográfica: puentes óseos al menos la mitad del área de fusión con al menos la densidad alcanzada originalmente en la cirugía. |
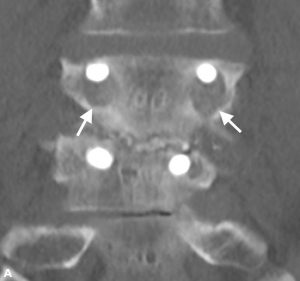
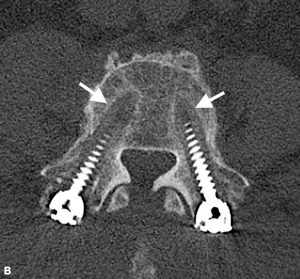
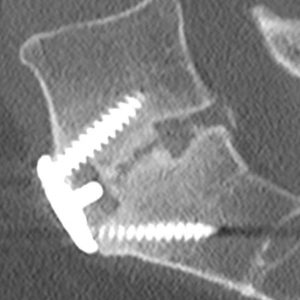
ESTRATEGIAS QUIRÚRGICAS
La decisión de ofrecer una intervención quirúrgica siempre debe ser un equilibrio de riesgos y beneficios. Un paciente asintomático con pseudoartrosis de un solo nivel puede no requerir intervención, pero un paciente con una fusión larga, incluso si es asintomático, puede justificar la consideración para evitar que la cirugía futura sea mucho más difícil. Cabe señalar que, incluso después de una fusión exitosa, los pacientes que habían sufrido una pseudoartrosis no lo hacen tan bien como aquellos que tuvieron una fusión exitosa después de su cirugía inicial.5
Enfoque
Las variaciones en el tratamiento quirúrgico de una pseudoartrosis son tantas y variadas como los métodos de realizar una fusión en primer lugar. Los principios generales a seguir son mejorar la estabilización, realizar nuevos injertos y restaurar la alineación sagital.45 Para mejorar la estabilización, se debe reemplazar la instrumentación claramente suelta y rota. A menudo, los tornillos pediculares se pueden «aumentar» en un milímetro o dos de diámetro para lograr un buen agarre en una trayectoria de tornillo previamente suelta. A veces también es posible alargar los tornillos, pero requiere una planificación preoperatoria cuidadosa. Se debe considerar extender la fijación a un segmento adyacente, especialmente si está asociado con enfermedad del segmento adyacente, pero hay que tener en cuenta que los niveles recién incorporados también necesitan lograr la fusión. En un sentido práctico, para una fusión lumbosacra fallida, extender la fijación al ilion a menudo es muy eficaz para mejorar la estabilización.46
La adición de injerto intersomático a una fusión posterolateral fallida es un medio para agregar material de injerto bajo compresión, así como para mejorar la estabilización. Al reemplazar un espacio de disco «blando» con una combinación de jaula e injerto relativamente más rígida, se mejora el soporte de la columna anterior. Dependiendo del nivel, esto se puede realizar a través de un abordaje anterior o lateral. También se puede usar una técnica TLIF o PLIF, pero lo más probable es que encuentre tejido cicatricial y aumente el riesgo de lesiones nerviosas y desgarros durales.
Equilibrio sagital
El equilibrio sagital siempre debe medirse y contabilizarse. Un paciente con pseudoartrosis con alineación sagital deficiente aún tendrá un resultado deficiente con una fusión sólida si no se aborda su alineación. Una osteotomía a través de una pseudoartrosis puede ser necesaria para lograr la corrección, pero una vez más, el cirujano debe optimizar la posibilidad de fusión logrando una buena aposición ósea, construcciones rígidas y fuertes y mejorando los factores de riesgo del propio paciente.
Estimulación
Existen algunas investigaciones para apoyar el uso de estimuladores de corriente continua,47,48, así como la estimulación de campo electromagnético pulsado.49-51 Desafortunadamente, ninguno de los dos métodos ha mostrado resultados consistentemente buenos y en gran medida ha quedado fuera de uso generalizado.
Injerto óseo
No hay sustituto sintético para el injerto de cresta ilíaca, y este siempre debe ser la fuente de material de injerto siempre que esté disponible para el tratamiento de la pseudoartrosis. Mientras que la rhBMP-2 ha demostrado ser equivalente a trasplante autólogo de injerto de hueso en dos grandes revisiones sistemáticas,52,53 no es sin costo ni complicaciones. Los aloinjertos carecen de propiedades osteoinductoras, al igual que la cerámica, como el fosfato tricálcico, y cuando el cirujano está tratando una pseudoartrosis, se deben evitar «rellenos» biológicamente inertes como estos.
CONCLUSIÓN
La pseudoartrosis sigue siendo uno de los problemas más difíciles a los que se enfrenta el cirujano de columna vertebral, y el riesgo de la misma debe discutirse con todos los posibles pacientes de fusión. La minimización de los riesgos de pseudoartrosis comienza mucho antes de que el bisturí toque la piel, con las investigaciones preoperatorias completadas, la planificación realizada y todos los factores de riesgo mitigados.
Cualquier paciente de fusión que no responda de la manera habitual debe señalar al cirujano la posibilidad de que se esté desarrollando pseudoartrosis. El cirujano que «culpa» al paciente no hace justicia a su paciente ni a sí mismo. Las investigaciones relevantes incluyen radiografías y tomografías computarizadas; deben notarse los cambios sutiles a lo largo del tiempo.
Una vez establecido el diagnóstico, se debe realizar una discusión cuidadosa y abierta sobre los beneficios y riesgos de la intervención quirúrgica, ya que esta decisión no siempre es clara. Una vez que se decide la intervención quirúrgica, el cirujano debe tener en cuenta el modo de falla, así como los pasos necesarios que tomará para lograr la fusión en una alineación aceptable. Desafortunadamente, no se puede esperar que el curso operatorio y postoperatorio sea rutinario, y se debe aconsejar al paciente que nunca logre el resultado esperado de su operación de índice.
PERLAS Y TRAMPAS
- En pacientes con un alto riesgo de desarrollo de pseudoartrosis, planifique y prepárese para realizar una cirugía que mitigue esos riesgos. La instrumentación mejora la velocidad de fusión, al igual que la realización de fusiones de 360°, ya sea a través de dos enfoques separados, o con injertos intersomáticos y posterolaterales bilaterales.
- Sospechar que un paciente está desarrollando una pseudoartrosis si sus resultados funcionales no mejoran como se esperaba.Las reconstrucciones de tomografía computarizada del plano coronal son la investigación de elección para encontrar una pseudoartrosis y, en particular, una «pseudoartrosis bloqueada».»El aflojamiento alrededor de los tornillos debe resolverse con el tiempo y debe seguirse cuidadosamente, pero la lucidez alrededor de una jaula intersomática es probable que sea el precursor de una eventual pseudoartrosis.
- El injerto óseo autólogo debe ser el material de injerto de elección.
LECTURA SUGERIDA
- Choudhri TF, Mummaneni PV, Dhall SS, et al. Actualización de la guía para la realización de procedimientos de fusión para enfermedades degenerativas de la columna lumbar. Parte 4: evaluación radiográfica del estado de fusión. Columna Vertebral de Neurocirugía J. 2014;21(1):23-30.
- Lee C, Dencil J, Radomisli TE. Nonunion of the spine: a review (en inglés). Clin Orthop Relat Res. 2004; (419): 71-75.
- Resnick DK, Choudhri TF, Dailey AT, et al. Directrices para la realización de procedimientos de fusión para enfermedades degenerativas de la columna lumbar. Parte 4: evaluación radiográfica de la fusión. Columna Vertebral de Neurocirugía J. 2005;2(6):653-657.
- Adogwa O, Parker SL, Shau D, et al. Costo por año de vida ajustado por calidad obtenido de la fusión de revisión para pseudoartrosis lumbar: definición del valor de la cirugía. J Técnica de Disorder Espinal. 2015;28(3):101-105.
- Chun DS, Baker KC, Hsu WK. Pseudoartrosis lumbar: una revisión del diagnóstico y el tratamiento actuales. Neurosurg Enfoque. 2015; 39 (4): E10.
- Raizman NM, O’Brien JR, Poehling-Monaghan KL, Yu WD. Pseudoartrosis de la columna vertebral. J Am Acad Orthop Surg. 2009; 17(8): 494-503.
- Hadley MN, Reddy SV. Smoking and the human vertebral column: a review of the impact of cigarette use on vertebral bone metabolism and spinal fusion (en inglés). Neurocirugía. 1997;41(1):116-124.
- Gertzbein SD, Hollopeter MR, Hall S. Pseudoartrosis de la columna lumbar. Resultado después de la fusión circunferencial. Vertebral. 1998; 23(21): 2352-2356; discussion 2356-2357.
- Brown CW ,mee TJ, Richardson HD. La tasa de pseudoartrosis (sin sindicato quirúrgico) en pacientes fumadores y pacientes no fumadores: un estudio comparativo. Vertebral. 1986;11(9):942-943.
- Bydon M, De la Garza-Ramos R, Abt NB, et al. Impacto del tabaquismo en las tasas de complicaciones y pseudoartrosis después de la fusión posterolateral de un solo nivel y de 2 niveles de la columna lumbar. Vertebral. 2014;39(21):1765-1770.
- Jenkins JD, Coric D, Branch CL Jr. Comparación clínica de fijación odontoide de uno y dos tornillos. Neurocirugía J. 1998;89(3):366-370.
- Deguchi M, Rapoff AJ, Zdeblick TA. Fusión posterolateral para espondilolistesis ismica en adultos: análisis de la tasa de fusión y resultados clínicos. J Disorden Espinal. 1998;11(6):459-464.
- Boden SD, Sumner DR. Factores biológicos que afectan la fusión espinal y la regeneración ósea. Vertebral. 1995; 20 (24 Suppl):102S-112S.
- Bono CM, Lee CK. Análisis crítico de las tendencias de la fusión para la enfermedad degenerativa del disco en los últimos 20 años: influencia de la técnica en la tasa de fusión y el resultado clínico. Vertebral. 2004; 29(4): 455-463; discussion Z5.
- Zdeblick TA. Un estudio prospectivo aleatorizado de fusión lumbar. Resultados preliminares. Vertebral. 1993;18(8):983-991.
- Nemoto O, Asazuma T, Yato Y, Imabayashi H, Yasuoka H, Fujikawa A. Comparación de las tasas de fusión tras la fusión intersomática lumbar transforaminal utilizando jaulas de polieteretercetona o jaulas de titanio con instrumentación transpedicular. Eur Spine J. 2014; 23(10): 2150-2155.
- Wu SH, Li Y, Zhang YQ, et al. La jaula de vanadio porosa de titanio-6 aluminio-4 tiene mejor osteointegración y menos micromoción que una jaula de poli-éter-éter-cetona en la fusión vertebral de ovejas. Artif Órganos. 2013; 37(12): E191-E201.
- Olivares-Navarrete R, Gittens RA, Schneider JM, et al. Los osteoblastos exhiben un fenotipo más diferenciado y una mayor producción de proteínas morfogenéticas óseas en sustratos de aleación de titanio que en poli-éter-éter-cetona. Spine J. 2012; 12 (3): 265-272.
- Bridwell KH, Lewis SJ, Lenke LG, Baldus C, Blanke K. Osteotomía por sustracción de pedículos para el tratamiento del desequilibrio sagital fijo. J Bone Joint Surg Am. 2003; 85-A (3): 454-463.
- Dickson DD, Lenke LG, Bridwell KH, Koester LA. Factores de riesgo y evaluación de pseudoartrosis sintomática después de osteotomía por sustracción de pedículo lumbar en deformidad espinal adulta. Vertebral. 2014;39(15):1190-1195.
- Deviren V, Tang JA, Scheer JK, et al. Rigidez de construcción después de la carga de fatiga en osteotomía por sustracción de pedículos con o sin jaulas estructurales intercuerpos adyacentes. Global Spine J. 2012; 2 (4): 213-220.
- Hyun SJ, Lenke LG, Kim YC, Koester LA, Blanke KM. Resultados radiográficos a largo plazo de una construcción de gancho central para el cierre de la osteotomía: seguimiento mínimo de 5 años. Vertebral. 2015; 40 (7): E428-E432.
- Kim YJ, Bridwell KH, Lenke LG, Rhim S, Cheh G. Pseudartrosis en la instrumentación de deformidad espinal adulta larga y fusión al sacro: análisis de prevalencia y factores de riesgo de 144 casos. Vertebral. 2006;31(20):2329-2336.
- DePalma AF, Rothman RH. La naturaleza de la pseudoartrosis. Clin Orthop Relat Res. 1968; 59: 113-118.
- Kornblum MB, Fischgrund JS, Herkowitz HN, Abraham DA, Berkower DL, Ditkoff JS. Espondilolistesis lumbar degenerativa con estenosis espinal: un estudio prospectivo a largo plazo que compara fusión y pseudoartrosis. Vertebral. 2004; 29(7): 726-733; discussion 733-734.
- Resnick DK, Choudhri TF, Dailey AT, et al. Directrices para la realización de procedimientos de fusión para enfermedades degenerativas de la columna lumbar. Parte 5: correlación entre resultado radiográfico y funcional. Columna Vertebral de Neurocirugía J. 2005;2(6):658-661.
- Klineberg E, Gupta M, McCarthy I, Hostin R. Detection of pseudarthrosis in adult spinal deformity: the use of health-related quality-of-life outcomes to predict pseudarthrosis. Clin Spine Surg. 2016; 29 (8): 318-322.
- Landis JR, Koch GG. La medición de la concordancia de los observadores para los datos categóricos. Biometría. 1977;33(1):159-174.
- Brodsky AE, Kovalsky ES, Khalil MA. Correlación de la evaluación radiológica de las fusiones de la columna lumbar con la exploración quirúrgica. Vertebral. 1991;16 (6 Suppl): S261-S265.
- Kant AP, Daum WJ, Dean SM, Uchida T. Evaluación de la fusión de la columna lumbar. Radiografías simples versus exploración y observación quirúrgica directa. Vertebral. 1995;20(21):2313-2317.
- Carreon LY, Djurasovic M, Glassman SD, Sailer P. Precisión y fiabilidad diagnósticas de tomografías computarizadas de corte fino con reconstrucciones para determinar el estado de una fusión posterolateral instrumentada con exploración quirúrgica como estándar de referencia. Vertebral. 2007;32(8):892-895.
- Carreon LY, Glassman SD, Schwender JD, Subach BR, Gornet MF, Ohno S. Fiabilidad y precisión de las exploraciones de tomografía computarizada de corte fino para determinar el estado de las fusiones intersomáticas anteriores con jaulas metálicas. Spine J. 2008; 8 (6): 998-1002.
- McAfee PC. Jaulas de fusión entre cuerpos en operaciones reconstructivas en la columna vertebral. J Bone Joint Surg Am. 1999;81(6):859-880.
- Shah RR, Mohammed S, Saifuddin A, Taylor BA. Comparación de radiografías simples con tomografía computarizada para evaluar la fusión intersomática tras el uso de jaulas intersomáticas de titanio e instrumentación transpedicular. Eur Spine J. 2003;12 (4): 378-385.Fogel GR, Toohey JS, Neidre A, Brantigan JW. Evaluación de fusión de la fusión intersomática lumbar posterior utilizando jaulas radiolúcidas: películas de rayos X y tomografías computarizadas helicoidales en comparación con la exploración quirúrgica de fusión. Spine J. 2008; 8 (4): 570-577.
- Kanemura T, Matsumoto A, Ishikawa Y, et al. Cambios radiográficos en pacientes con seudartrosis después de artrodesis intersomática lumbar posterior utilizando jaulas intersomáticas de carbono: un estudio prospectivo de cinco años. J Bone Joint Surg Am. 2014; 96 (10): e82.
- Kröner AH, Eyb R, Lange A, Lomoschitz K, Mahdi T, Engel A. Evaluación de imágenes por resonancia magnética de la fusión intersomática lumbar posterior. Vertebral. 2006;31(12):1365-1371.
- Lang P, Chafetz N, Genant HK, Morris JM. Fusión espinal lumbar. Evaluación de la estabilidad funcional con imágenes por resonancia magnética. Vertebral. 1990;15(6):581-588.
- Johnsson R, Selvik G, Strömqvist B, Sundén G. Movilidad de la columna lumbar inferior tras fusión posterolateral determinada por análisis estereofotogramétrico de roentgen. Vertebral. 1990;15(5):347-350.
- Johnsson R, Axelsson P, Gunnarsson G, Strömqvist B. Estabilidad de la fusión lumbar con fijación transpedicular determinada por análisis estereofotogramétrico de roentgen. Vertebral. 1999;24(7):687-690.
- Bohnsack M, Gossé F, Rühmann O, Wenger K. El valor de la centellografía en el diagnóstico de pseudoartrosis después de la cirugía de fusión espinal. J Disorden Espinal. 1999;12(6):482-484.McMaster MJ, Merrick MV. La evaluación centellográfica de la columna escoliótica después de la fusión. Cirugía de Articulación Ósea J Br. 1980; 62-B (1): 65-72.
- Jacobson JA, Starok M, Pathria MN, Garfin SR. Pseudoartrosis: evaluación estadounidense después de la fusión espinal posterolateral: trabajo en curso. Radiología. 1997;204(3):853-858.
- Heggeness MH, Esses SI. Clasificación de pseudoartrosis de la columna lumbar. Vertebral. 1991;16 (8 Suppl): S449-S454.
- Lenke LG, Bridwell KH, Bullis D, Betz RR, Baldus C, Schoenecker PL. Resultados de fusión in situ para espondilolistesis ismica. J Disorden Espinal. 1992;5(4):433-442.
- Brantigan JW, Steffee AD. Un implante de fibra de carbono para ayudar a la fusión lumbar entre cuerpos. Resultados clínicos a dos años en los primeros 26 pacientes. Vertebral. 1993;18(14):2106-2107.
- Santos ER, Goss DG, Morcom RK, Fraser RD. Evaluación radiológica de la fusión entre cuerpos utilizando jaulas de fibra de carbono. Vertebral. 2003;28(10):997-1001.
- Larsen J, Capen DA. Pseudoartrosis de la columna lumbar. J Am Acad Orthop Surg. 1997; 5 (3): 153-162.
- Kuklo TR, Bridwell KH, Lewis SJ, et al. Análisis mínimo de 2 años de fijación sacropélvica y fusión L5-S1 utilizando tornillos S1 e ilíacos. Vertebral. 2001;26(18):1976-1983.
- Tejano NA, Puno R, Ignacio JM. El uso de estimulación de corriente continua implantable en la fusión espinal multinivel sin instrumentación. Una evaluación clínica y radiográfica prospectiva con seguimiento a largo plazo. Vertebral. 1996;21(16):1904-1908.
- Goodwin CB, Brighton CT, Guyer RD, Johnson JR, Light KI, Yuan HA. Un estudio doble ciego de estimulación eléctrica acoplada capacitivamente como complemento de las fusiones de la columna lumbar. Vertebral. 1999; 24(13): 1349-1356; discussion 1357.
- Hodges SD, Eck JC, Humphreys SC. Uso de estimulación eléctrica ósea en la fusión espinal. J Am Acad Orthop Surg. 2003; 11(2): 81-88.
- Simmons JW. Tratamiento de la fusión intersomática lumbar posterior fallida (PLIF) de la columna vertebral con campos electromagnéticos pulsantes. Clin Orthop Relat Res. 1985; (193): 127-132.
- Simmons JW Jr, Mooney V, Thacker I. Pseudoartrosis después de la fusión de la columna lumbar: salvamento no operativo con campos electromagnéticos pulsados. Soy J Orthop. 2004;33(1):27-30.
- Simmonds MC, Brown JV, Heirs MK, et al. Safety and effectiveness of recombinant human bone morphogenetic protein-2 for spinal fusion: a meta-analysis of individual-participant data (en inglés). Ann Intern Med. 2013;158(12):877-889.
- Fu R, Selph S, McDonagh M, et al. Effectiveness and harms of recombinant human bone morphogenetic protein-2 in spine fusion: a systematic review and meta-analysis (en inglés). Ann Intern Med. 2013;158(12):890-902.