John E. Cunningham
INTRODUCTION
La pseudarthrose, ou non-union, est une complication trop courante et coûteuse de la chirurgie de fusion vertébrale, le coût par QALY (année de vie ajustée en fonction de la qualité) gagné étant estimé à environ 118 945 US US.1 Les estimations de taux varient considérablement entre les études utilisant différents techniques chirurgicales et populations de patients.2
La pseudarthrose est généralement définie comme une défaillance de l’union osseuse entre deux vertèbres dans les 12 mois suivant la chirurgie.3 Tant que la fusion osseuse solide n’est pas atteinte, le chirurgien ne doit pas considérer que son patient a atteint un point final chirurgical, quelle que soit l’indication initiale de la chirurgie de fusion.
La prévention de la pseudarthrose peut être difficile, tout comme le diagnostic et le traitement. Une partie de la difficulté de la prévention peut être les facteurs de risque du patient qui sont souvent non modifiables à court terme. Les chirurgiens sont encouragés à prendre note de ces facteurs de risque et à modifier leur traitement chirurgical pour atténuer ces risques du mieux qu’ils le peuvent. Parfois, cela peut inclure de retarder ou même d’annuler une intervention chirurgicale si le risque de pseudarthrose et le résultat médiocre qui en résulte l’emportent sur tout bénéfice prévu de la chirurgie.
La présentation de la pseudarthrose comprend le plus souvent une douleur, qui est généralement de nature centrale et dont l’apparition peut survenir plusieurs mois après l’opération. L’investigation et le diagnostic impliquent le plus souvent un scanner à coupe fine, et la prise en compte de l’infection concomitante doit toujours être incluse. Le traitement implique le plus souvent une chirurgie de révision utilisant une multitude de techniques.
FACTEURS DE RISQUE
Les facteurs patients jouent un rôle important en ce qui concerne le risque de pseudarthrose. Le tabagisme est l’un des facteurs de risque les mieux étudiés.4,5 Brown et coll., a réalisé une étude randomisée de 100 patients subissant une fusion non instrumentée à deux niveaux de L4 au sacrum.6 Les non-fumeurs avaient un taux de pseudarthrose de 8%, alors que les fumeurs réguliers avaient un taux cinq fois plus élevé, à 40%. Une étude plus récente a examiné l’impact du tabagisme en présence d’instruments à vis pédiculaires, mais sans dispositifs intercoraux.7 Pour les fusions à un niveau, ils n’ont trouvé aucune différence dans les taux de fusion, mais pour les fusions à deux niveaux, la pseudarthrose était trois fois plus élevée (29% contre 11%).
Les autres facteurs qui influencent le taux d’union sont ceux qui ne devraient pas surprendre un chirurgien orthopédiste, car ils sont similaires à ceux des non-unions générales. Ceux-ci incluent l’âge, l’utilisation de stéroïdes et d’AINS, le diabète, la malnutrition et la chirurgie antérieure.8,9 Le rayonnement périopératoire diminue également les taux de fusion, 10 ce qui doit être pris en compte lors du traitement des patients atteints de tumeurs.
D’un point de vue chirurgical, le nombre de niveaux augmente le risque de pseudarthrose, tout comme l’utilisation d’une fixation non rigide.9,11 L’instrumentation de toute nature augmente le taux de fusion par rapport aux fusions non instrumentées.12 Dans l’ordre des taux de fusion, l’emplacement de fusion circonférentiel donne le plus élevé (intercorps ainsi que postérolatéral), suivi de l’intercorps postérieur, de l’intercorps antérieur puis postérolatéral.11 Il est prouvé que les dispositifs intercorps en titane fusionnent plus rapidement et plus souvent que ceux en PEEK.13-15
Ostéotomie par soustraction du pédicule
L’opération d’ostéotomie par soustraction du pédicule (OSP) est réalisée en nombre croissant à la fois en raison de notre plus grande appréciation du malalignement sagittal ainsi que de notre population vieillissante.16 L’une des complications majeures est la pseudarthrose, qui survient chez environ 10% des patients.17 La pseudarthrose survient le plus souvent au niveau de l’ostéotomie, et les facteurs de risque comprennent la réalisation de l’opération pour la prise en charge d’une pseudarthrose préexistante, la radiothérapie préopératoire, la présence d’un trouble neurologique ou inflammatoire et l’absence de fusion intercorps directement au-dessus de l’ostéotomie. Cette dernière observation est étayée par des études cadavériques.18 Il apparaît que les cages inter-corps améliorent les taux de fusion en augmentant la rigidité de la structure. C’est aussi pour cette raison que les auteurs choisissent d’ajouter une troisième tige aux constructions PSO, d’un niveau supérieur à un niveau inférieur au site d’ostéotomie en utilisant des connecteurs côte à côte et une tige en chrome-cobalt, similaire à la technique décrite par Hyun et al.19
Chirurgie de déformation de la colonne vertébrale
Dans une étude d’opérations de déformation incluant le sacrum, le taux de pseudarthrose s’est avéré être de 24%.20 Toutes les pseudarthroses ont été détectées avant quatre ans après la chirurgie, en moyenne 27 mois, et se sont produites soit à la jonction thoracolumbaire, soit à la jonction lombo-sacrée. Les facteurs de risque identifiés étaient la cyphose thoracolumbaire et une approche thoracoabdominale (pour la pseudarthrose thoracolumbaire), l’arthrose des hanches et un équilibre sagittal positif ≥ 5 cm (pour la pseudarthrose lombo-sacrée), et l’âge > 55. Comme prévu, les patients atteints de pseudarthrose avaient des scores Scoliosis Research Society (SRS) inférieurs à ceux avec une fusion solide (71 contre 90/120).
PRÉSENTATION
La pseudarthrose peut se présenter de trois manières différentes. Le patient peut être asymptomatique et avoir une bonne fonction, il peut être symptomatique ou présenter une pseudarthrose associée à une autre entité pathologique telle qu’une infection.
Scores des résultats fonctionnels
On ne sait toujours pas pourquoi de nombreux patients atteints de pseudarthrose restent asymptomatiques et présentent de bons résultats fonctionnels. Une petite étude de 1968 a comparé les résultats des patients atteints de fusion de solides par rapport à la pseudarthrose et a trouvé peu de différence.21 La description de la fusion est donnée en Hibbs ou en type « H », et on peut donc supposer que les auteurs effectuaient des fusions non instrumentées. Une étude plus moderne sur les fusions non instrumentées n’a pas trouvé les mêmes résultats, avec seulement 56% des patients atteints d’une pseudarthrose obtenant des résultats acceptables par rapport à 86% des patients atteints d’une fusion solide.22
En examinant les études sur les fusions instrumentées, il existe des preuves mitigées de la corrélation entre une union solide et un bon résultat. Une revue de Resnick et coll. a conclu que « la majorité des preuves médicales de classe III suggèrent qu’une fusion radiographique réussie est associée à de meilleurs résultats cliniques. » 23 Certaines de ces études ont été randomisées, mais ont tout de même été classées dans la classe III en raison de taux de croisement élevés.
Lors d’un examen de patients atteints de malformations consécutives dans un établissement, tous les patients présentant une pseudarthrose avérée à un an ou plus n’ont pas réussi à améliorer leurs scores SRS ou Oswestry Disability Index (ODI).24 En fait, l’absence d’amélioration de ces scores était plus précise pour détecter la pseudarthrose que les rayons X simples. Cela a également été noté dans l’étude sur la scoliose discutée précédemment.20 Cette découverte amène les auteurs à conclure que la notation des résultats fonctionnels est essentielle au suivi postopératoire des patients atteints de malformation et devrait servir de déclencheur pour une investigation plus approfondie de la pseudarthrose.
Pseudarthrose asymptomatique
La détection de la pseudarthrose chez le patient asymptomatique est généralement le résultat d’une surveillance par le chirurgien et invite à une réflexion intéressante. Par exemple, si un patient a une pseudarthrose et est pourtant asymptomatique et fonctionne bien, faut-il gagner à l’exposer à des radiations pour trouver une anomalie qui ne nécessitera probablement pas d’intervention chirurgicale? Dans quelles circonstances la détection d’une pseudarthrose va-t-elle changer la prise en charge par le chirurgien d’un patient asymptomatique? Il serait raisonnable qu’après une intervention à plusieurs niveaux ou une ostéotomie, la détection et le traitement précoces d’une pseudarthrose asymptomatique puissent prévenir des complications catastrophiques à l’avenir, et la surveillance est donc raisonnable. Cela peut être fait de manière efficace et efficiente avec des systèmes de notation standard. Cependant, après une procédure à un seul niveau, il est peu probable qu’il y ait une complication majeure à l’avenir, même si elle ne s’unissait pas, le dépistage radiologique est donc peut-être moins important.
Pseudarthrose symptomatique
Dans le cas d’une pseudarthrose symptomatique, la présentation est généralement celle d’une aggravation du mal de dos axial. La douleur peut être une aggravation de la douleur initiale de l’opération (« ne s’est jamais améliorée”) ou peut être une nouvelle apparition. Les patients atteints de scoliose peuvent se plaindre d’une aggravation de la déformation bien que ce ne soit pas courant. En cas de spondylarthrite ankylosante, les patients peuvent être sensibles à leur horizon visuel. Les symptômes neurologiques sont inhabituels sauf si la déformation segmentaire est considérable.
Pseudarthrose concomitante
Le diagnostic concomitant le plus probable est une infection. Des antécédents de fièvres, un retour imprévu au bloc opératoire, un traitement antibiotique à long terme et celui d’une plaie d’évacuation suggèrent fortement une infection. Une perte de poids et un malaise peuvent également accompagner la présentation. Tout autre portail d’infection doit être examiné.
INVESTIGATION
L’investigation d’une pseudarthrose suspectée doit tenir compte des diagnostics différentiels ou concomitants probables. Bien que difficiles à interpréter au départ, la CRP et la RSE doivent être examinées, de même que tout autre sang suggérant une infection. La plaie doit être inspectée et tout gonflement ou prélèvement des tissus mous doit être documenté. Toute collecte de liquide doit être échantillonnée et envoyée pour des tests de microscopie, de culture et de sensibilité. Même les examens préopératoires peuvent manquer des infections de bas grade, de sorte que le chirurgien doit être préparé au cas où du liquide purulent serait rencontré lors de la révision.
Études d’imagerie
Analyse statistique
Toute discussion sur les études d’imagerie, ou tout autre test diagnostique d’ailleurs, doit inclure une appréciation de la sensibilité et de la spécificité, et des valeurs 𝜅 (kappa). Tout chirurgien doit connaître ces termes et savoir comment ils peuvent être utilisés pour guider notre prise de décision. Pour les besoins de la lecture du texte ci-dessous, les tests sont analysés comme essayant de détecter une fusion. Par conséquent, la sensibilité fait référence à la chance d’identifier correctement une fusion tandis que la spécificité fait référence à la chance d’identifier correctement une pseudarthrose.
Un test de faible sensibilité peut « manquer” une fusion solide et peut encourager le chirurgien à effectuer des interventions inutiles pour tenter de réparer une pseudarthrose ostensible, qui est en réalité solide. Un test de faible spécificité, en revanche, peut « manquer » une pseudarthrose et laisser le chirurgien et le patient croire que la fusion est solide, alors qu’en fait elle ne l’est pas.
La valeur de kappa, ou coefficient de kappa de Cohen, est une mesure de l’accord entre observateurs et varie entre 0 (pas d’accord, ou accord uniquement par hasard) et 1 (accord parfait). Une valeur de 0,41-0.60 est considéré comme montrant un accord modéré, et 0,61-0,80 accord substantiel. Les valeurs supérieures à 0,81 sont considérées comme un accord « presque parfait » dans les domaines biomédicaux.25 La signification pratique de ceci est que même si un test présente une sensibilité et une spécificité élevées, une faible valeur de kappa devrait indiquer au chirurgien que le résultat réel peut être fortement dépendant de l’observateur. Un moyen de contourner ce problème peut être d’obtenir un consensus en présentant les résultats à plusieurs spécialistes.
Rayons X
Rayons X simples
Deux des meilleures études portant sur les radiographies simples sont celles de Brodsky et Kant.26,27 Leurs résultats étaient assez similaires. La corrélation entre les rayons X statiques simples et l’exploration chirurgicale était de 64 à 68%, avec une sensibilité de 85 à 89% mais une faible spécificité de 60 à 62%. Si une radiographie démontre une fusion solide, en d’autres termes, elle est susceptible d’être solide, mais si elle suggère une pseudarthrose, on ne peut pas s’y fier. Le délai entre la chirurgie et la détection d’une pseudarthrose par radiographie est également assez long, avec une moyenne de 3,5 ans.20
Un autre problème est la grande variabilité dans l’interprétation des rayons X, tant inter-qu’intra-observateurs. Dans une étude où les rayons X ont été évalués par deux chirurgiens et deux radiologues, le 𝜅 = 0,4-0,7, indiquant une mauvaise corrélation. Par conséquent, malgré la nature relativement peu coûteuse des rayons X simples et leur disponibilité, les auteurs ne les recommandent pas pour l’évaluation de la fusion solide.
Rayons X cintrés ou dynamiques
Les films cintrés ou dynamiques, également appelés études de flexion-extension, fonctionnent de manière similaire aux rayons X simples lors de l’étude de la pseudarthrose. Dans la même étude de Brodsky et al. référencé ci-dessus, il a été constaté que bien qu’une absence de mouvement sur ces études soit bien corrélée avec la fusion solide, le mouvement n’indique pas nécessairement une pseudarthrose.26
Tomodensitométrie (TDM)
Dans l’étude déjà discutée par Brodsky et al., La tomodensitométrie n’a montré qu’une sensibilité de 63%, une spécificité de 86%, une valeur prédictive positive de 72% et une valeur prédictive négative de 81%. Ces résultats n’étaient pas radicalement différents des rayons X ordinaires, mais il faut garder à l’esprit que cette étude, et beaucoup de celles qui l’aiment, ont été réalisées à la fin des années 1980.Il n’est donc pas surprenant que des études plus modernes, avec des scanners multi-tranches hélicoïdaux plus modernes, aient montré de bien meilleurs résultats. Malheureusement, peu de gens ont comparé l’imagerie à l’exploration chirurgicale.
Fusions postérolatérales
Deux études plus récentes ont comparé les résultats de la tomodensitométrie à l’exploration chirurgicale. Dans leur article de 2007, 28 Carreon et al. a utilisé des tomodensitogrammes à tranche axiale de 1 mm imprimés sur film et les a fait évaluer par trois chirurgiens de la colonne vertébrale. Fait intéressant, ils ont documenté la fusion à travers l’articulation facettaire ainsi que la fusion dans les gouttières postérolatérales. Lorsque la fusion a été observée dans les deux facettes et les deux gouttières postérolatérales, la probabilité d’une fusion solide à l’exploration était de 96%. Si elle n’a été observée que dans les gouttières postérolatérales, cela a chuté à 89%, et enfin s’il n’y avait que fusion observée à travers les joints facettaires, alors la chance de voir une fusion solide lors de l’exploration était de 74%. Cependant, l’absence de fusion entre les deux articulations facettaires ou une gouttière postérolatérale n’a pas permis de prédire de manière fiable la pseudarthrose lors de l’exploration.
Fusions Intercorps lombaires antérieures (ALIF)
Dans le deuxième article portant sur les fusions intercorps lombaires antérieures à l’aide de cages métalliques par Carreon et al., 29 un protocole similaire a été utilisé. Bien qu’il y ait une variabilité importante parmi les observateurs, lorsque le consensus a été obtenu, la tomodensitométrie avait une sensibilité de 93% et une spécificité de 46% pour la fusion. Le signe sentinelle antérieur30 n’avait qu’une sensibilité de 20 % et une spécificité de 92% pour détecter une fusion, alors que le signe sentinelle postérieur s’est avéré plus précis, avec une sensibilité de 67 % et une spécificité de 79 %. L’absence de signe sentinelle antérieur est un bon test de pseudarthrose.
Fusions Intercorps Lombaires postérieures / Transforaminales (PLIF/TLIF)
L’évaluation de la fusion intercorps est souvent problématique. L’artefact peut souvent interférer avec l’imagerie par tomodensitométrie, en particulier lorsqu’il est effectué sur de vieilles machines, et les marqueurs au tantale dans des cages en PEEK ou en fibre de carbone peuvent souvent laisser un artefact spectaculaire (Fig. 4-1). Les machines hélicoïdales modernes à plusieurs tranches avec des algorithmes de suppression d’artefacts plus sophistiqués ont rendu la tâche beaucoup plus facile, et les reconstructions de plans coronaux sont excellentes pour visualiser la masse de fusion entre les corps.
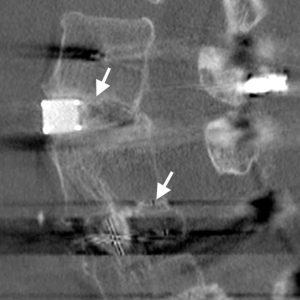
Shah et al.31 a effectué des tomodensitogrammes sur des patients 6 mois après l’opération qui avaient subi un PLIF à l’aide de cages en titane, où la seule greffe osseuse était emballée dans les cages. Il a décrit une trabéculation osseuse pontante à la fois dans les cages, mais aussi à l’extérieur des cages où aucune greffe osseuse n’avait été emballée. Des similitudes avec le signe sentinelle ont été notées. Il a également constaté que la tomodensitométrie était beaucoup plus sensible à la détermination de la présence ou de l’absence d’une interface de cage de plaque d’extrémité radiotransparente que les rayons X, avec un accord très élevé entre les observateurs. Fogel et coll., 32 d’autre part, a constaté qu’il y avait peu de différence entre les tomodensitogrammes et les rayons X lors de l’évaluation de la fusion après PLIF. La difficulté avec l’article est cependant qu’il n’y avait que quatre cas de pseudarthrose trouvés lors de l’exploration sur les 172 niveaux explorés chirurgicalement. Avec un taux de pseudarthrose aussi faible de 2.3%, les calculs de sensibilité et de spécificité peuvent être fortement influencés par des changements de détection relativement faibles.
Un article très utile de Kanemura et al.33 suivi des changements radiographiques au fil du temps. Ils ont examiné 153 patients jusqu’à cinq ans après l’opération après le PLIF en utilisant une greffe osseuse locale et une crête iliaque. Ils ont constaté que le mouvement ≥ 5 ° sur les rayons X dynamiques était maximal à un an, mais diminuait ensuite régulièrement avec le temps. De même, ils ont constaté que, à l’aide de rayons X et de tomodensitométrie, les zones radiotransparentes autour des vis pédiculaires étaient également maximales à un an, mais résolues ensuite sans intervention chirurgicale de trois à quatre ans. L’os de pontage antérieur a commencé à se former à trois mois, puis a continué. Le volume de la greffe osseuse intercoréenne avait tendance à diminuer de 6 mois, puis à augmenter à nouveau après deux à trois ans.
Avec autant de changements associés à la pseudarthrose présents à la marque postopératoire de 6 à 12 mois, cet article met le chirurgien au défi de retarder l’intervention chirurgicale pour la pseudarthrose jusqu’à ce qu’au moins deux ou trois ans se soient écoulés, car de nombreux changements se résoudront sans intervention. L’un des changements est-il associé au diagnostic éventuel de pseudarthrose? Le seul facteur prédictif trouvé était la présence d’une zone radiotransparente autour de la cage intercoréenne de plus de 1 mm à 12 et 18 mois. Il s’agissait d’un prédicteur indépendant, associé à l’affaissement, au mouvement et à la diminution de la greffe osseuse intercoréenne.
Imagerie par résonance magnétique
Bien que certaines études aient examiné la précision de l’IRM,34,35, elle n’a pas été comparée favorablement à la tomodensitométrie ou à l’exploration opératoire. Il peut donner au chirurgien des informations sur les changements modiques présents dans l’espace du disque fusionné, mais il n’a pas été démontré que cela soit en corrélation fiable avec la fusion ou la pseudarthrose.
Analyse stéréophotogrammétrique de Roentgen (RSA)
La RSA est une technique par laquelle des marqueurs au tantale sont intégrés dans les vertèbres osseuses au moment de la chirurgie. Une imagerie standardisée est ensuite prise des billes dans la période postopératoire, et le mouvement peut être mesuré avec précision.36 Cette technique souffre d’un problème similaire à celui des rayons X dynamiques, en ce sens que le mouvement, ou son absence, n’est pas nécessairement corrélé à la pseudarthrose. Par exemple, selon RSA, il peut n’y avoir aucun mouvement sur un segment immédiatement après la chirurgie, mais de toute évidence, aucune fusion n’a encore été établie.37 Il est utilisé uniquement à des fins de recherche, et la corrélation clinique avec la fusion doit être effectuée avec soin.
Médecine nucléaire
Le balayage osseux au technétium-99m est souvent utilisé pour évaluer l’activité de l’os autour d’une masse de fusion. On pense qu’il est corrélé à la fusion car le scan est « froid”. Les preuves de son utilité font cependant défaut. Par rapport à l’exploration chirurgicale, bien qu’elle soit spécifique (93%), elle manquait de sensibilité (50%) et n’avait qu’une valeur prédictive positive de 40% lors de la recherche d’une pseudarthrose.38 Résultats similaires ont été trouvés lors de l’examen de patients atteints de scoliose.39 On pense que le principal problème est que la technique est incapable de faire la différence entre la pseudarthrose établie et la masse de fusion immature.
Échographie
L’utilisation de l’échographie a été évaluée dans une petite étude, comparant l’apparence des structures postérieures à l’exploration chirurgicale.40 Bien qu’elle ait semblé prometteuse, sa capacité à évaluer la masse de fusion antérieure est limitée. Aucune autre étude n’a été réalisée.
CLASSIFICATION
Fusion postérolatérale
Heggeness et Esses ont été les premiers à classer les types morphologiquement différents de pseudarthrose des fusions postérolatérales (Tableau 4-1).41 Ils ont également décrit le « signe de bardeau » qui est couramment observé dans le type de pseudarthrose de bardeau, dans lequel un ruban d’os semble flotter derrière les éléments postérieurs en regardant une tranche axiale de CT. Cette classification est utile en ce qu’elle suggère la cause de la pseudarthrose.
| Type | Description |
| atrophie et résorption de la masse osseuse de fusion | |
| Transverse | masse osseuse adéquate mais une discontinuité horizontale persiste |
| Bardeau | variation de la transversale où la discontinuité est oblique |
| Complexe | la présence de multiples défauts de fusion |
Lenke et al.42 décrit une classification plus qualitative de la masse de fusion postérolatérale, allant de A « définitivement solide » à D « définitivement non solide » (tableau 4-2). Bien que cela puisse être utile pour décrire les fusions, cela aide le chirurgien à diagnostiquer ou à traiter la complication.
| Type | Raccourci | Description |
| A | définitivement solide | solides grandes masses de fusion bilatérales trabéculées |
| B | peut-être solide | grande masse de fusion unilatérale avec une petite masse de fusion controlatérale |
| C | probablement pas solide | petites masses de fusion minces bilatéralement |
| D | certainement pas solide | résorption bilatérale de greffe ou masse de fusion avec pseudarthrose bilatérale évidente |
Fusion inter-corps
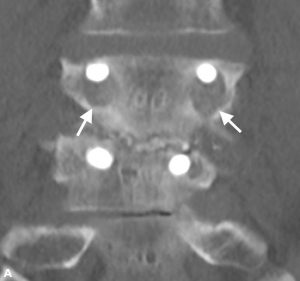
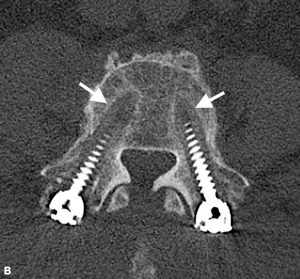
Brantigan et Steffee ont d’abord décrit une classification de la fusion inter-corps à travers leur cage en fibre de carbone.43 Modifiée plus tard par Fraser, elle est généralement connue sous le nom de classification BSF (Brantigan, Steffee, Fraser) (tableau 4-3).32,44 La pseudarthrose est évaluée par tomodensitométrie et classée BSF-1 lorsqu’il y a des signes bruts de mouvement (Fig. 4-2), ou BSF-2 où il y a une lucence horizontale à travers l’espace inter-corps (Fig. 4-3). Ce dernier est généralement connu sous le nom de « pseudarthrose verrouillée”. En ce qui concerne la fusion, ils considéraient la fusion comme solide si l’os se développait à travers l’une des cages PLIF, même si l’autre avait de la lucence à travers elle.
| Description | |
| BSF-1 | La pseudarthrose radiographique est indiquée par l’effondrement de la construction
|
| BSF-2 | La pseudarthrose radiographique verrouillée est indiquée par la lucence visible dans le milieu des cages avec un os solide poussant dans la cage à partir de chaque plaque d’extrémité vertébrale. |
| BSF-3 | Fusion radiographique: ponts osseux au moins la moitié de la zone de fusion avec au moins la densité initialement atteinte lors de la chirurgie. |
STRATÉGIES CHIRURGICALES
La décision d’offrir une intervention chirurgicale doit toujours être un équilibre entre les risques et les avantages. Un patient asymptomatique avec une pseudarthrose à un seul niveau peut ne pas nécessiter d’intervention, mais un patient avec une longue fusion, même si elle est asymptomatique, peut justifier une considération pour éviter de rendre la chirurgie future beaucoup plus difficile. Il convient de noter que, même après une fusion réussie, les patients qui avaient souffert d’une pseudarthrose ne font pas aussi bien que ceux qui ont eu une fusion réussie après leur chirurgie initiale.5
Approche
Les variations dans le traitement chirurgical d’une pseudarthrose sont aussi nombreuses et variées que les méthodes de réalisation d’une fusion en premier lieu. Les principes généraux à suivre sont d’améliorer la stabilisation, d’effectuer de nouvelles greffes et de rétablir l’alignement sagittal.45 Afin d’améliorer la stabilisation, les instruments clairement desserrés et cassés doivent être remplacés. Souvent, les vis pédiculaires peuvent être « surdimensionnées » d’un millimètre ou de deux de diamètre pour obtenir une bonne adhérence dans une trajectoire de vis précédemment desserrée. L’allongement des vis est également parfois possible mais nécessite une planification préopératoire minutieuse. L’extension de la fixation à un segment adjacent doit être envisagée surtout si elle est associée à une maladie du segment adjacent, mais il faut garder à l’esprit que les niveaux nouvellement incorporés doivent également réaliser la fusion. Dans un sens pratique, pour une fusion lombo-sacrée ratée, l’extension de la fixation à l’ilium est souvent très efficace pour améliorer la stabilisation.46
L’ajout d’une greffe intercoréenne à une fusion postérolatérale défaillante est un moyen d’ajouter du matériau de greffe sous compression, ainsi que d’améliorer la stabilisation. En remplaçant un espace disque « mou » par une combinaison cage et greffe relativement plus rigide, le support de la colonne antérieure est amélioré. Selon le niveau, cela peut être effectué par une approche antérieure ou latérale. Une technique TLIF ou PLIF peut également être utilisée, mais celles-ci rencontreront très probablement du tissu cicatriciel et augmenteront le risque de lésion nerveuse et de déchirures durales.
Équilibre sagittal
L’équilibre sagittal doit toujours être mesuré et pris en compte. Un patient avec une pseudarthrose dans un mauvais alignement sagittal aura toujours un mauvais résultat avec une fusion solide si leur alignement n’est pas abordé. Une ostéotomie par pseudarthrose peut être nécessaire pour obtenir une correction, mais une fois de plus, le chirurgien doit optimiser les chances de fusion en obtenant une bonne apposition osseuse, des constructions rigides et solides et en améliorant les propres facteurs de risque du patient.
Stimulation
Certaines recherches existent pour soutenir l’utilisation de stimulateurs de courant CONTINU, 47, 48 ainsi que la stimulation par champ électromagnétique pulsé.49-51 Malheureusement, aucune des deux méthodes n’a toujours donné de bons résultats et n’est en grande partie plus largement utilisée.
Greffe osseuse
Il n’y a pas de substitut synthétique à la greffe de crête iliaque, et cela devrait toujours être la source de matériel de greffe chaque fois qu’il est disponible pour le traitement de la pseudarthrose. Bien qu’il ait été démontré que le rhBMP-2 était équivalent à la greffe osseuse autologue dans deux grandes revues systématiques 52,53, il n’est pas sans coût ni complications. Les allogreffes n’ont pas de propriétés ostéoinductives, tout comme les céramiques telles que le phosphate tricalcique, et lorsque le chirurgien traite une pseudarthrose, de telles « charges” biologiquement inertes doivent être évitées.
CONCLUSION
La pseudarthrose reste l’un des problèmes les plus difficiles auxquels le chirurgien de la colonne vertébrale est confronté, et son risque doit être discuté avec tous les patients potentiels atteints de fusion. La minimisation des risques de pseudarthrose commence bien avant que le scalpel ne touche la peau, avec des investigations préopératoires terminées, une planification effectuée et tous les facteurs de risque atténués.
Tout patient de fusion qui ne répond pas de la manière habituelle doit signaler au chirurgien la possibilité qu’une pseudarthrose se développe. Le chirurgien qui « blâme » le patient ne rend pas justice à son patient ou à lui-même. Les investigations pertinentes comprennent les rayons X et les tomodensitogrammes; des changements subtils au fil du temps doivent être notés.
Une fois le diagnostic établi, une discussion attentive et ouverte doit avoir lieu sur les avantages et les risques de l’intervention chirurgicale car cette décision n’est pas toujours claire. Une fois l’intervention chirurgicale décidée, le chirurgien doit prendre en compte le mode d’échec ainsi que les étapes nécessaires pour réaliser la fusion dans un alignement acceptable. Malheureusement, on ne peut s’attendre à ce que le cours opératoire et postopératoire soit routinier et il faut informer le patient qu’il pourrait ne jamais atteindre le résultat attendu de son opération d’index.
PERLES ET PIÈGES
- Chez les patients présentant un risque élevé de développement de pseudarthrose, planifiez et préparez-vous à effectuer une intervention chirurgicale qui atténuera ces risques. L’instrumentation améliore la vitesse de fusion, tout comme la réalisation de fusions à 360 ° soit par deux approches distinctes, soit avec des greffes inter-corps ainsi que des greffes postérolatérales bilatérales.
- Suspectez qu’un patient développe une pseudarthrose si ses résultats fonctionnels ne s’améliorent pas comme prévu.
- Les reconstructions par tomodensitométrie du plan coronal sont l’investigation de choix pour trouver une pseudarthrose, et, en particulier, une « pseudarthrose verrouillée.”
- Le desserrage autour des vis devrait se résorber avec le temps et devrait être suivi attentivement, mais la lucence autour d’une cage intercorps est susceptible d’être le précurseur d’une éventuelle pseudarthrose.
- La greffe osseuse autologue doit être le matériau de greffe de choix.
LECTURE SUGGÉRÉE
- Choudhri TF, Mummaneni PV, Dhall SS, et al. Mise à jour des lignes directrices pour l’exécution des procédures de fusion pour les maladies dégénératives de la colonne lombaire. Partie 4 : évaluation radiographique de l’état de fusion. J Colonne vertébrale en neurochirurgie. 2014;21(1):23-30.
- Lee C, Dorcil J, Radomisli TE. Non Union de la colonne vertébrale: un examen. Clin Orthop Relat Res. 2004; (419): 71-75.
- Resnick DK, Choudhri TF, Dailey AT, et al. Lignes directrices pour l’exécution des procédures de fusion pour les maladies dégénératives de la colonne lombaire. Partie 4 : évaluation radiographique de la fusion. J Colonne vertébrale en neurochirurgie. 2005;2(6):653-657.
- Adogwa O, Parker SL, Shau D, et al. Coût par année de vie ajustée en fonction de la qualité acquise de la fusion de révision pour la pseudoarthrose lombaire: définition de la valeur de la chirurgie. J Technologie de Disordement de la Colonne vertébrale. 2015;28(3):101-105.
- Chun DS, Baker KC, Hsu SEM. Pseudarthrose lombaire: un examen du diagnostic et du traitement actuels. Foyer de neurochirurgie. 2015; 39(4): E10.
- Raizman NM, O’Brien JR, Poehling-Monaghan KL, Yu WD. Pseudarthrose de la colonne vertébrale. J Am Acad Orthop Surg. 2009; 17 (8): 494-503.
- Hadley MN, Reddy SV. Le tabagisme et la colonne vertébrale humaine: examen de l’impact de l’utilisation de la cigarette sur le métabolisme des os vertébraux et la fusion vertébrale. Neurochirurgie. 1997;41(1):116-124.
- Gertzbein SD, Hollopeter MR, Hall S. Pseudarthrose de la colonne lombaire. Résultat après fusion circonférentielle. Vertébrale. 1998; 23 (21): 2352-2356; discussion 2356-2357.
- Brun CW, Orme TJ, Richardson HD. Le taux de pseudarthrose (non-union chirurgicale) chez les patients fumeurs et les patients non fumeurs: une étude de comparaison. Vertébrale. 1986;11(9):942-943.
- Bydon M, De la Garza-Ramos R, Abt NB, et al. Impact du tabagisme sur les taux de complication et de pseudarthrose après fusion postérolatérale à un et 2 niveaux de la colonne lombaire. Vertébrale. 2014;39(21):1765-1770.
- Jenkins JD, Coric D, Branch CL Jr. Une comparaison clinique de la fixation odontoïde à une et deux vis. J Neurochirurgie. 1998;89(3):366-370.
- Deguchi M, Rapoff AJ, Zdeblick TA. Fusion postérolatérale pour le spondylolisthésis isthmique chez l’adulte: analyse du taux de fusion et des résultats cliniques. J Disordement de la colonne vertébrale. 1998;11(6):459-464.
- Boden SD, Sumner DR. Facteurs biologiques affectant la fusion spinale et la régénération osseuse. Vertébrale. 1995; 20 (24 Suppl): 102S-112S.
- Bono CM, Lee CK. Analyse critique des tendances de la fusion pour la discopathie dégénérative au cours des 20 dernières années: influence de la technique sur le taux de fusion et les résultats cliniques. Vertébrale. 2004; 29(4): 455-463; discussion Z5.
- Zdeblick TA. Une étude prospective et randomisée de la fusion lombaire. Résultats préliminaires. Vertébrale. 1993;18(8):983-991.
- Nemoto O, Asazuma T, Yato Y, Imabayashi H, Yasuoka H, Fujikawa A. Comparaison des taux de fusion après la fusion intercorps lombaire transforaminale à l’aide de cages en polyétheréthercétone ou de cages en titane avec instrumentation transpédiculaire. Eur Spine J. 2014; 23 (10): 2150-2155.
- Wu SH, Li Y, Zhang YQ, et al. La cage poreuse en titane-6 aluminium-4 vanadium présente une meilleure ostéointégration et moins de micromotion qu’une cage poly-éther-éther-cétone dans la fusion vertébrale des moutons. Orgues Artif. 2013; 37(12): E191-E201.
- Olivares-Navarrete R, Gittens RA, Schneider JM, et al. Les ostéoblastes présentent un phénotype plus différencié et une production accrue de protéines morphogénétiques osseuses sur des substrats en alliage de titane que sur le poly-éther-éther-cétone. Spine J. 2012; 12 (3): 265-272.
- Bridwell KH, Lewis SJ, Lenke LG, Baldus C, Blanke K. Ostéotomie par soustraction du pédicule pour le traitement du déséquilibre sagittal fixe. J Articulation Osseuse Surg Am. 2003; 85-A(3): 454-463.
- Dickson DD, Lenke LG, Bridwell KH, Koester LA. Facteurs de risque et évaluation de la pseudarthrose symptomatique après ostéotomie par soustraction du pédicule lombaire chez l’adulte. Vertébrale. 2014;39(15):1190-1195.
- Deviren V, Tang JA, Scheer JK, et coll. Construire la rigidité après la charge de fatigue dans l’ostéotomie par soustraction du pédicule avec ou sans cages structurelles intercorales adjacentes. Colonne vertébrale globale J. 2012; 2 (4): 213-220.
- Hyun SJ, Lenke LG, Kim YC, Koester LA, Blanke KM. Résultats radiographiques à long terme d’une construction de tige de crochet centrale pour la fermeture de l’ostéotomie: suivi minimum de 5 ans. Vertébrale. 2015; 40(7): E428-E432.
- Kim YJ, Bridwell KH, Lenke LG, Rhim S, Cheh G. Pseudarthrosis in long adult spinal deformity instrumentation and fusion to the sacrum: analyse de la prévalence et des facteurs de risque de 144 cas. Vertébrale. 2006;31(20):2329-2336.
- DePalma AF, Rothman RH. La nature de la pseudarthrose. Clin Orthop Relat Res. 1968; 59:113-118.
- Kornblum MB, Fischgrund JS, Herkowitz HN, Abraham DA, Berkower DL, Ditkoff JS. spondylolisthésis lombaire dégénératif avec sténose spinale: une étude prospective à long terme comparant la fusion et la pseudarthrose. Vertébrale. 2004; 29(7): 726-733; discussion 733-734.
- Resnick DK, Choudhri TF, Dailey AT, et al. Lignes directrices pour l’exécution des procédures de fusion pour les maladies dégénératives de la colonne lombaire. Partie 5: corrélation entre les résultats radiographiques et fonctionnels. J Colonne vertébrale en neurochirurgie. 2005;2(6):658-661.
- Klineberg E, Gupta M, McCarthy I, Hostin R. Detection of pseudarthrosis in adult spinal deformity: the use of health-related quality-of-life outcomes to predict pseudarthrosis. Clin Spine Surg. 2016; 29 (8): 318-322.
- Landis JR, Koch GG. La mesure de l’accord des observateurs pour les données catégorielles. Biométrie. 1977;33(1):159-174.
- Brodsky AE, Kovalsky ES, Khalil MA. Corrélation de l’évaluation radiologique des fusions de la colonne lombaire avec l’exploration chirurgicale. Vertébrale. 1991;16 (6 Suppl): S261-S265.
- Kant AP, Daum WJ, Dean SM, Uchida T. Évaluation de la fusion de la colonne lombaire. Radiographies simples par rapport à l’exploration et à l’observation chirurgicales directes. Vertébrale. 1995;20(21):2313-2317.
- Carreon LY, Djurasovic M, Glassman SD, Sailer P. Précision diagnostique et fiabilité des tomodensitogrammes à coupe fine avec reconstructions pour déterminer l’état d’une fusion postérolatérale instrumentée avec exploration chirurgicale comme étalon de référence. Vertébrale. 2007;32(8):892-895.
- Carreon LY, Glassman SD, Schwender JD, Subach BR, Gornet MF, Ohno S. Fiabilité et précision des analyses de tomodensitométrie à coupe fine pour déterminer l’état des fusions intercorulaires antérieures avec des cages métalliques. Spine J. 2008; 8 (6): 998-1002.
- McAfee PC. Cages de fusion intercorps dans les opérations de reconstruction de la colonne vertébrale. J Articulation Osseuse Surg Am. 1999;81(6):859-880.
- Shah RR, Mohammed S, Saifuddin A, Taylor BA. Comparaison de radiographies simples avec tomodensitométrie pour évaluer la fusion intercorps après l’utilisation de cages intercorps en titane et d’instrumentation transpédiculaire. Eur Spine J. 2003; 12(4): 378-385.
- Fogel GR, Toohey JS, Neidre A, Brantigan JW. Évaluation de la fusion de la fusion intercorps lombaire postérieure à l’aide de cages radiotransparentes: films radiographiques et tomodensitogrammes hélicoïdaux comparés à l’exploration chirurgicale de la fusion. Spine J. 2008; 8 (4): 570-577.
- Kanemura T, Matsumoto A, Ishikawa Y, et al. Changements radiographiques chez les patients atteints de pseudarthrose après une arthrodèse inter-corps lombaire postérieure à l’aide de cages inter-corps en carbone: une étude prospective de cinq ans. J Articulation Osseuse Surg Am. 2014; 96(10): e82.
- Kröner AH, Eyb R, Lange A, Lomoschitz K, Mahdi T, Engel A. Évaluation de l’imagerie par résonance magnétique de la fusion intercorps lombaire postérieure. Vertébrale. 2006;31(12):1365-1371.
- Lang P, Chafetz N, Genant HK, Morris JM. Fusion vertébrale lombaire. Évaluation de la stabilité fonctionnelle avec imagerie par résonance magnétique. Vertébrale. 1990;15(6):581-588.
- Johnsson R, Selvik G, Strömqvist B, Sundén G. Mobilité de la colonne lombaire inférieure après fusion postérolatérale déterminée par analyse stéréophotogrammétrique de roentgen. Vertébrale. 1990;15(5):347-350.
- Johnsson R, Axelsson P, Gunnarsson G, Strömqvist B. Stabilité de la fusion lombaire avec fixation transpédiculaire déterminée par analyse stéréophotogrammétrique de roentgen. Vertébrale. 1999;24(7):687-690.
- Bohnsack M, Gossé F, Rühmann O, Wenger K. La valeur de la scintigraphie dans le diagnostic de la pseudarthrose après une chirurgie de fusion vertébrale. J Disordement de la colonne vertébrale. 1999;12(6):482-484.
- McMaster MJ, Merrick MV. L’évaluation scintigraphique de la colonne vertébrale scoliotique après la fusion. J Articulation Osseuse Surg Br. 1980; 62-B(1): 65-72.
- Jacobson JA, Starok M, Pathria MN, Garfin SR. Pseudarthrose: Évaluation américaine après fusion spinale postérolatérale: travaux en cours. Radiologie. 1997;204(3):853-858.
- Heggeness MH, Esses SI. Classification des pseudarthroses de la colonne lombaire. Vertébrale. 1991;16 (8 Suppl): S449-S454.
- Lenke LG, Bridwell KH, Bullis D, Betz RR, Baldus C, Schoenecker Pl. Résultats de la fusion in situ pour le spondylolisthésis isthmique. J Disordement de la colonne vertébrale. 1992;5(4):433-442.
- Brantigan JW, Steffee AD. Un implant en fibre de carbone pour faciliter la fusion lombaire entre les corps. Résultats cliniques sur deux ans chez les 26 premiers patients. Vertébrale. 1993;18(14):2106-2107.
- Santos ER, Goss DG, Morcom RK, Fraser RD. Évaluation radiologique de la fusion entre corps à l’aide de cages en fibre de carbone. Vertébrale. 2003;28(10):997-1001.
- Larsen J, Capen DA. Pseudarthrose de la colonne lombaire. J Am Acad Orthop Surg. 1997; 5 (3): 153-162.
- Kuklo TR, Bridwell KH, Lewis SJ, et al. Analyse d’au moins 2 ans de la fixation sacropelvique et de la fusion L5-S1 à l’aide de vis S1 et iliaques. Vertébrale. 2001;26(18):1976-1983.
- Tejano NA, Puno R, Ignacio JM. L’utilisation de la stimulation par courant continu implantable dans la fusion vertébrale à plusieurs niveaux sans instrumentation. Une évaluation clinique et radiographique prospective avec suivi à long terme. Vertébrale. 1996;21(16):1904-1908.
- Goodwin CB, Brighton CT, Guyer RD, Johnson JR, Light KI, Yuan HA. Une étude en double aveugle de la stimulation électrique couplée de manière capacitive en complément des fusions de la colonne vertébrale lombaire. Vertébrale. 1999; 24(13): 1349-1356; discussion 1357.
- Hodges SD, Eck JC, Humphreys SC. Utilisation de la stimulation osseuse électrique dans la fusion spinale. J Am Acad Orthop Surg. 2003; 11 (2): 81-88.
- Simmons JW. Traitement de l’échec de la fusion intercorps lombaire postérieure (PLIF) de la colonne vertébrale avec des champs électromagnétiques pulsants. Clin Orthop Relat Res. 1985; (193): 127-132.
- Simmons JW Jr, Mooney V, Thacker I. Pseudarthrose après fusion de la colonne lombaire: récupération non opératoire avec champs électromagnétiques pulsés. Am J Orthop. 2004;33(1):27-30.
- Simmonds MC, Brown JV, Heirs MK, et al. Safety and effectiveness of recombinant human bone morphogenetic protein-2 for spinal fusion: a meta-analysis of individual-participant data. Ann Stagiaire Med. 2013;158(12):877-889.
- Fu R, Selph S, McDonagh M, et al. Effectiveness and harms of recombinant human bone morphogenetic protein-2 in spine fusion: a systematic review and meta-analysis. Ann Stagiaire Med. 2013;158(12):890-902.