John E. Cunningham
INTRODUZIONE
Pseudoartrosi, o non-unione, è fin troppo diffusa e costosa complicazione di fusione spinale chirurgia, con il costo per QALY (quality-adjusted life year) ha guadagnato il stimato pari a circa US$118,945.1 Tasso stime variano notevolmente tra gli studi che utilizzano diverse tecniche chirurgiche e popolazioni di pazienti.2
La pseudartrosi è solitamente definita come fallimento dell’unione ossea tra due vertebre entro 12 mesi dall’intervento chirurgico.3 Fino al raggiungimento della fusione ossea solida, il chirurgo non deve considerare che il paziente abbia raggiunto un endpoint chirurgico, indipendentemente dall’indicazione iniziale per l’intervento di fusione.
La prevenzione della pseudartrosi può essere difficile, così come la diagnosi e il trattamento. Parte della difficoltà di prevenzione possono essere i fattori di rischio del paziente che sono spesso non modificabili a breve termine. I chirurghi sono incoraggiati a prendere nota di questi fattori di rischio e modificare il loro trattamento chirurgico per migliorare tali rischi come meglio possono. Occasionalmente, questo può includere ritardare o addirittura annullare l’intervento chirurgico se il rischio di pseudartrosi e il risultato negativo risultante superano qualsiasi beneficio previsto della chirurgia.
La presentazione della pseudartrosi comprende più spesso il dolore, che di solito è di natura centrale e la cui insorgenza può essere di molti mesi dopo l’operazione. L’indagine e la diagnosi più comunemente comprendono l’esame fine-tagliato di CT e la considerazione dell’infezione concomitante dovrebbe sempre essere inclusa. Il trattamento più spesso comporta un intervento chirurgico di revisione che impiega una moltitudine di tecniche.
FATTORI DI RISCHIO
I fattori del paziente svolgono un ruolo significativo per quanto riguarda il rischio di pseudartrosi. Il fumo è uno dei fattori di rischio meglio studiati.4,5 Brown et al., ha eseguito uno studio randomizzato su 100 pazienti sottoposti a fusione non strumentale a due livelli da L4 al sacro.6 I non fumatori avevano un tasso di pseudartrosi dell ‘ 8%, mentre i fumatori regolari avevano un tasso cinque volte superiore, al 40%. Uno studio più recente ha esaminato l’impatto del fumo in presenza di strumentazione a vite a peduncolo, ma senza dispositivi intercorpi.7 Per le fusioni a livello singolo non hanno trovato alcuna differenza nei tassi di fusione, ma per le fusioni a due livelli, la pseudartrosi era tre volte superiore (29% vs. 11%).
Altri fattori del paziente che influenzano il tasso di unione sono quelli che non dovrebbero sorprendere un chirurgo ortopedico, in quanto sono simili a quelli per i non sindacati generali. Questi includono l’età, l’uso di steroidi e FANS, diabete, malnutrizione e chirurgia precedente.La radiazione perioperatoria 8,9 diminuisce anche i tassi di fusione,10 che devono essere presi in considerazione quando si trattano pazienti con tumori.
Da un punto di vista chirurgico, il numero di livelli aumenta il rischio di pseudartrosi, così come l’uso della fissazione non rigida.9,11 La strumentazione di qualsiasi tipo aumenta il tasso di fusione rispetto alle fusioni non strumentate.12 In ordine di velocità di fusione, la posizione di fusione circonferenziale dà il più alto (interbody e posterolaterale), seguito da interbody posteriore, interbody anteriore e quindi posterolaterale.11 Ci sono prove che i dispositivi intercorpi in titanio si fondono più velocemente e più spesso di quelli fatti di PEEK.13-15
Peduncolo Sottrazione Osteotomia
L’operazione di peduncolo sottrazione osteotomia (PSO) viene eseguita in numero crescente sia a causa della nostra maggiore apprezzamento del malallineamento sagittale così come la nostra popolazione che invecchia.16 Una delle principali complicanze è la pseudoartrosi, che si verifica in circa il 10% dei pazienti.17 La pseudoartrosi più spesso si verifica a livello dell’osteotomia, e i fattori di rischio includono l’esecuzione dell’operazione per la gestione di un pre-esistente pseudoartrosi, radioterapia preoperatoria, la presenza di un neurologici o disturbo infiammatorio, e la mancanza di una fusione intervertebrale direttamente sopra l’osteotomia. Quest’ultima osservazione è supportata da studi cadaverici.18 Sembra che le gabbie intercorpi migliorino i tassi di fusione aumentando la rigidità della struttura. È anche per questo motivo che gli autori scelgono di aggiungere una terza asta ai costrutti PSO, da un livello sopra a un livello sotto il sito di osteotomia usando connettori side-to-side e un’asta cromo-cobalto, simile alla tecnica descritta da Hyun et al.19
Chirurgia della deformità spinale
In uno studio sulle operazioni di deformità che includevano il sacro, il tasso di pseudartrosi è risultato essere del 24%.20 Tutte le pseudartrosi sono state rilevate prima di quattro anni dopo l’intervento chirurgico a una media di 27 mesi e si sono verificate alla giunzione toracolombare o alla giunzione lombosacrale. I fattori di rischio identificati sono stati la cifosi toracolombare e un approccio toracoaddominale (per pseudartrosi toracolombare), l’osteoartrosi delle anche e un bilancio sagittale positivo ≥ 5 cm (per pseudartrosi lombosacrale), e l’età > 55. Come previsto, i pazienti con pseudartrosi avevano punteggi più bassi della Scoliosi Research Society (SRS) rispetto a quelli con una fusione solida (71 vs. 90/120).
PRESENTAZIONE
La pseudartrosi può presentarsi in tre modi diversi. Il paziente può essere asintomatico e avere una buona funzione, può essere sintomatico o può avere una pseudoartrosi associata a un’altra entità patologica come l’infezione.
Risultati funzionali
Non è chiaro perché molti pazienti con pseudartrosi rimangono asintomatici e hanno buoni risultati funzionali. Un piccolo studio del 1968 ha confrontato i risultati dei pazienti con fusione di solidi contro pseudartrosi e ha trovato poca differenza.21 La descrizione della fusione è data come Hibbs o tipo”H”, e si può supporre quindi che gli autori stessero eseguendo fusioni non strumentate. Uno studio più moderno di fusioni non strumentate non ha trovato gli stessi risultati, con solo il 56% dei pazienti con una pseudartrosi che ha raggiunto risultati accettabili rispetto all ‘ 86% dei pazienti con una fusione solida.22
Quando si esaminano studi di fusioni strumentate, vi sono prove miste della correlazione tra unione solida e buon risultato. Una recensione di Resnick et al. ha concluso che ” la maggior parte delle prove mediche di classe III suggerisce che la fusione radiografica di successo è associata a risultati clinici migliorati.”23 Alcuni di questi studi sono stati randomizzati ma sono stati ancora classificati come Classe III a causa di alti tassi di crossover.
In un esame di pazienti con deformità consecutivi in un istituto, tutti i pazienti con una pseudartrosi provata a un anno o più non sono riusciti a migliorare i loro punteggi SRS o Oswestry Disability Index (ODI).24 In effetti, la mancanza di miglioramento in questi punteggi è stata più accurata nel rilevare la pseudartrosi rispetto ai normali raggi X. Questo è stato notato anche nello studio sulla scoliosi discusso in precedenza.20 Questa scoperta porta gli autori a concludere che il punteggio funzionale dell’esito è essenziale per monitorare i pazienti con deformità postoperatoria e dovrebbe servire da trigger per ulteriori indagini per la pseudartrosi.
Pseudartrosi asintomatica
Il rilevamento della pseudartrosi nel paziente asintomatico è di solito il risultato della sorveglianza da parte del chirurgo e richiede una considerazione interessante. Ad esempio, se un paziente ha una pseudartrosi e tuttavia è asintomatico e funziona bene, c’è qualcosa da guadagnare esponendoli alle radiazioni per trovare un’anomalia che molto probabilmente non richiederà un intervento chirurgico? In quali circostanze la rilevazione di una pseudartrosi cambierà la gestione del chirurgo di un paziente asintomatico? Sarebbe ragionevole che dopo qualsiasi procedura multilivello o osteotomia, la diagnosi precoce e il trattamento di una pseudoartrosi asintomatica possano prevenire complicazioni catastrofiche in futuro, e quindi la sorveglianza è ragionevole. Questo può essere fatto in modo efficace ed efficiente con sistemi di punteggio standard. Seguendo una procedura a livello unico, tuttavia, è improbabile che ci sarebbe qualche complicazione importante in futuro anche se non si unisse, quindi lo screening radiologico è forse meno importante.
Pseudoartrosi sintomatica
Nel caso della pseudoartrosi sintomatica, la presentazione è solitamente di un peggioramento del mal di schiena assiale. Il dolore può essere un peggioramento del dolore originale dell’operazione (“mai migliorato”) o può essere un nuovo inizio. I pazienti con scoliosi possono lamentare un peggioramento della deformità, sebbene ciò non sia comune. Nel caso della spondilite anchilosante, i pazienti possono essere sensibili al loro orizzonte visivo. I sintomi neurologici sono insoliti a meno che la deformità segmentale non sia considerevole.
Pseudartrosi concomitante
La diagnosi concomitante più probabile è l’infezione. Una storia di febbri, un ritorno non pianificato in sala operatoria, una terapia antibiotica a lungo termine e quella di una ferita da scarica è fortemente indicativa di infezione. La perdita di peso e il malessere possono anche accompagnare la presentazione. Eventuali altri portali per l’infezione dovrebbero essere esaminati.
INDAGINE
L’indagine su una sospetta pseudartrosi dovrebbe tenere conto di probabili diagnosi differenziali o concomitanti. Anche se difficile da interpretare inizialmente, CRP e VES dovrebbero essere esaminati, così come qualsiasi altro sangue suggestivo di infezione. La ferita deve essere ispezionata e qualsiasi gonfiore dei tessuti molli o raccolta documentata. Qualsiasi raccolta di liquidi deve essere campionata e inviata per test di microscopia, coltura e sensibilità. Anche le indagini preoperatorie possono perdere infezioni di basso grado, quindi il chirurgo deve essere preparato nel caso in cui si verifichi un liquido purulento al momento della revisione.
Studi di imaging
Analisi statistica
Qualsiasi discussione di studi di imaging, o qualsiasi altro test diagnostico per quella materia, deve includere un apprezzamento della sensibilità e specificità, e valori 𝜅 (kappa). Qualsiasi chirurgo deve avere familiarità con questi termini e come possono essere utilizzati per guidare il nostro processo decisionale. Ai fini della lettura del testo sottostante, i test vengono analizzati come tentativo di rilevare una fusione. Quindi, la sensibilità si riferisce alla possibilità di identificare correttamente una fusione mentre la specificità si riferisce alla possibilità di identificare correttamente una pseudartrosi.
Un test di bassa sensibilità può “perdere” una fusione solida e può incoraggiare il chirurgo a eseguire procedure non necessarie nel tentativo di correggere una pseudoartrosi apparente, che è in realtà solida. Un test a bassa specificità, d’altra parte, può “mancare” una pseudoartrosi e lasciare al chirurgo e al paziente la convinzione che la fusione sia solida, quando in realtà non lo è.
Il valore kappa, o coefficiente kappa di Cohen, è una misura dell’accordo tra osservatori e varia tra 0 (nessun accordo, o accordo solo per caso) e 1 (accordo perfetto). Un valore di 0.41-0.60 è considerato come mostrando moderato accordo, e 0.61-0.80 sostanziale accordo. Valori superiori a 0,81 sono considerati come “quasi perfetto” accordo nel campo biomedico.25 Il significato pratico di questo è che anche se un test ha un’alta sensibilità e specificità, un basso valore kappa dovrebbe segnalare al chirurgo che il risultato effettivo può essere fortemente dipendente dall’osservatore. Un modo per aggirare questo potrebbe essere quello di ottenere il consenso presentando i risultati a più specialisti.
Raggi X
Raggi X semplici
Due dei migliori studi che esaminano le radiografie semplici sono quelli di Brodsky e Kant.26,27 I loro risultati sono stati abbastanza simili. La correlazione tra i raggi X statici semplici e l’esplorazione chirurgica è stata del 64-68%, con una sensibilità dell ‘ 85-89% ma una bassa specificità del 60-62%. Se una radiografia dimostra una fusione solida, in altre parole, allora è probabile che sia solida, ma se suggerisce la pseudartrosi, allora non può essere invocata. Anche il tempo dall’intervento chirurgico al rilevamento di una pseudoartrosi mediante raggi X è piuttosto lungo, con una media di 3,5 anni.20
Un altro problema è la grande variabilità nell’interpretazione dei raggi X, sia inter-che intra – observer. In uno studio in cui i raggi X sono stati valutati da due chirurghi e due radiologi, il 𝜅 = 0.4–0.7, indicando scarsa correlazione. Pertanto, nonostante la relativa natura economica dei raggi X semplici e la loro disponibilità, gli autori non li raccomandano per la valutazione della fusione solida.
Flessione o raggi X dinamici
La flessione o i film dinamici, noti anche come studi di estensione della flessione, eseguono in modo simile ai raggi X normali quando si studia la pseudartrosi. Nello stesso studio di Brodsky et al. fatto riferimento sopra, è stato trovato che mentre un’assenza di movimento su questi studi è correlata bene con la fusione solida, il movimento non indica necessariamente la pseudartrosi.26
Tomografia computerizzata (CT)
Nello studio già discusso da Brodsky et al., la scansione CT è stata trovata solo per avere una sensibilità del 63%, specificità dell ‘86%, valore predittivo positivo del 72% e valore predittivo negativo dell’ 81%. Questi risultati non erano drammaticamente diversi dai raggi X semplici, ma bisogna tenere a mente che questo studio, e molti simili, sono stati eseguiti alla fine del 1980. Non dovrebbe sorprendere, quindi, che studi più moderni, con più moderni scanner multi-slice elicoidali, hanno mostrato risultati molto migliori. Sfortunatamente, non molti hanno paragonato l’imaging all’esplorazione chirurgica.
Fusioni posterolaterali
Due studi più recenti hanno confrontato i risultati della scansione TC con l’esplorazione chirurgica. Nel loro articolo del 2007, 28 Carreon et al. ha usato scansioni TC assiali da 1 mm stampate su pellicola e le ha valutate da tre chirurghi della colonna vertebrale. È interessante notare che hanno documentato la fusione attraverso l’articolazione delle faccette e la fusione nelle grondaie posterolaterali. Quando la fusione è stata vista in entrambe le sfaccettature e in entrambe le grondaie posterolaterali, la possibilità di una fusione solida all’esplorazione era del 96%. Se è stato visto solo nelle grondaie posterolaterali, questo è sceso all ‘ 89%, e infine se c’era solo fusione vista attraverso le faccette, allora la possibilità di vedere una fusione solida all’esplorazione era del 74%. Tuttavia, l’assenza di fusione attraverso entrambe le faccette articolari o una grondaia posterolaterale non ha predetto in modo affidabile la pseudartrosi durante l’esplorazione.
Fusioni interbody lombari anteriori (ALIF)
Nel secondo documento guardando fusioni interbody lombari anteriori utilizzando gabbie metalliche di Carreon et al., 29 un protocollo simile è stato usato. Sebbene ci fosse una sostanziale variabilità tra gli osservatori, quando è stato ottenuto il consenso, la TAC aveva una sensibilità del 93% e una specificità del 46% per la fusione. Il segno sentinella anteriore30 aveva solo una sensibilità del 20% e una specificità del 92% per rilevare una fusione, mentre il segno sentinella posteriore si è dimostrato più accurato, con sensibilità del 67% e specificità del 79%. L’assenza di un segno di sentinella anteriore è un buon test per la pseudartrosi.
Fusioni intercorpi lombari posteriori/transforaminali (PLIF/TLIF)
La valutazione della fusione intercorpo è spesso problematica. L’artefatto può spesso interferire con l’imaging CT, in particolare se eseguito su vecchie macchine, e i marcatori di tantalio all’interno di gabbie in PEEK o in fibra di carbonio possono spesso lasciare un artefatto drammatico (Fig. 4-1). Le moderne macchine elicoidali multi-slice con algoritmi di rimozione dei manufatti più sofisticati hanno reso il compito molto più semplice e le ricostruzioni del piano coronale sono eccellenti per visualizzare la massa di fusione tra corpi.
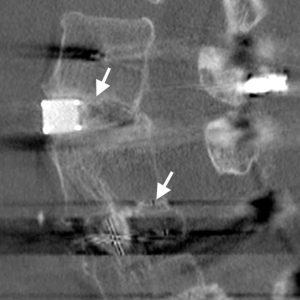
Shah et al.31 ha eseguito scansioni TC su pazienti 6 mesi dopo l’intervento che erano stati sottoposti a un PLIF utilizzando gabbie di titanio, dove l’unico innesto osseo è stato imballato all’interno delle gabbie. Ha descritto la trabecolazione ossea a ponte sia all’interno delle gabbie, ma anche all’esterno delle gabbie in cui non era stato imballato alcun innesto osseo. Sono state notate somiglianze con il segno sentinella. Ha anche scoperto che la TC era molto più sensibile nel determinare la presenza o l’assenza di un’interfaccia a gabbia radiotrasparente rispetto ai raggi X, con un accordo molto elevato tra gli osservatori. Fogel et al., 32 d’altra parte, ha scoperto che c’era poca differenza tra le scansioni TC e i raggi X nel valutare la fusione dopo PLIF. La difficoltà con la carta però è che c’erano solo quattro casi di pseudartrosi trovati all’esplorazione su 172 livelli esplorati chirurgicamente. Con un tasso di pseudartrosi così basso di 2.3%, i calcoli di sensibilità e specificità possono essere fortemente influenzati da cambiamenti relativamente piccoli nel rilevamento.
Un documento molto utile di Kanemura et al.33 cambiamenti radiografici monitorati nel tempo. Hanno esaminato 153 pazienti fino a cinque anni dopo l’intervento dopo PLIF utilizzando l’innesto osseo locale e la cresta iliaca. Hanno scoperto che il movimento ≥ 5° sui raggi X dinamici era massimo a un anno, ma poi diminuiva costantemente nel tempo. Allo stesso modo, hanno scoperto che, usando i raggi X e la scansione CT, le zone radiotrasparenti intorno alle viti del peduncolo erano anche massime a un anno, ma poi risolte senza intervento chirurgico da tre a quattro anni. L’osso a ponte anteriore ha cominciato a formarsi a tre mesi e poi ha continuato. Il volume dell’innesto osseo intercorpo tendeva a diminuire di 6 mesi, per poi aumentare nuovamente dopo due o tre anni.
Con così tanti cambiamenti associati alla pseudartrosi presenti al segno postoperatorio da 6 a 12 mesi, questo documento sfida il chirurgo a ritardare l’intervento chirurgico per la pseudartrosi fino a quando non sono trascorsi almeno due o tre anni, poiché molti cambiamenti si risolveranno senza intervento. C’è qualche cambiamento associato all’eventuale diagnosi di pseudartrosi? L’unico predittore trovato è stata la presenza di una zona radiotrasparente intorno alla gabbia interbody superiore a 1 mm a 12 e 18 mesi. Questo era un predittore indipendente e associato a subsidenza, movimento e diminuzione dell’innesto osseo intercorpo.
Imaging a risonanza magnetica
Sebbene ci siano stati alcuni studi che esaminano l’accuratezza della risonanza magnetica,34,35 non è stato confrontato favorevolmente con la TC o l’esplorazione operativa. Può dare al chirurgo informazioni sui cambiamenti modici presenti nello spazio del disco fuso, ma questo non ha dimostrato di correlare in modo affidabile alla fusione o alla pseudoartrosi.
Roentgen Analisi stereofotogrammetrica (RSA)
RSA è una tecnica per cui marcatori di tantalio sono incorporati all’interno delle vertebre ossee al momento dell’intervento chirurgico. L’imaging standardizzato viene quindi prelevato dalle perline nel periodo postoperatorio e il movimento può essere misurato con precisione.36 Questa tecnica soffre di un problema simile a quello dei raggi X dinamici, in quanto il movimento, o la sua mancanza, non è necessariamente correlato alla pseudartrosi. Ad esempio, secondo RSA non ci può essere alcun movimento attraverso un segmento immediatamente dopo l’intervento chirurgico, ma ovviamente nessuna fusione ha ancora stabilito.37 Viene utilizzato solo a scopo di ricerca e la correlazione clinica con la fusione deve essere fatta con attenzione.
Medicina nucleare
La scansione ossea del tecnezio-99m viene spesso utilizzata per valutare l’attività dell’osso attorno a una massa di fusione. Si pensa che sia correlato alla fusione poiché la scansione è “fredda”. La prova della sua utilità è, tuttavia, carente. Rispetto all’esplorazione chirurgica, sebbene fosse specifica (93%), mancava di sensibilità (50%) e aveva solo un valore predittivo positivo del 40% quando si cercava la pseudartrosi.38 risultati simili sono stati trovati guardando i pazienti con scoliosi.39 Si pensa che il problema principale sia che la tecnica non è in grado di distinguere tra pseudoartrosi stabilita e massa di fusione immatura.
Ultrasuoni
L’uso degli ultrasuoni è stato valutato in un piccolo studio, confrontando l’aspetto delle strutture posteriori con l’esplorazione chirurgica.40 Anche se sembrava essere promettente, è limitata nella sua capacità di valutare la massa di fusione anteriore. Non sono stati effettuati ulteriori studi.
CLASSIFICAZIONE
Fusione posterolaterale
Heggeness ed Esses furono i primi a classificare morfologicamente diversi tipi di pseudoartrosi delle fusioni posterolaterali (Tabella 4-1).41 Hanno anche descritto il “segno di ghiaia” che è comunemente visto nel tipo di ghiaia di pseudoartrosi, in cui una scheggia di osso visto galleggiare dietro gli elementi posteriori quando si guarda una fetta CT assiale. Questa classificazione è utile in quanto è suggestiva della causa della pseudartrosi.
| Tipo | Descrizione |
| Atrofica | atrofia e il riassorbimento di fusione della massa ossea |
| Trasversale | adeguata massa ossea, ma orizzontale discontinuità persiste |
| Ghiaia | variazione trasverso, dove la discontinuità è obliqua |
| Complesso | la presenza di molteplici difetti di fusione |
Lenke et al.42 ha descritto una classificazione più qualitativa della massa di fusione posterolaterale, che va da un “decisamente solido” a D “sicuramente non solido” (Tabella 4-2). Mentre questo può essere utile per descrivere le fusioni, dà l’assistenza del chirurgo nella diagnosi o nel trattamento della complicazione.
| Tipo | Sintetici | Descrizione |
| A | sicuramente solido | solid grande trabeculated bilaterali fusione masse |
| B | possibilmente solido | unilaterale grande fusione di massa con controlaterale fusione di piccoli di massa |
| C | probabilmente non solido | piccolo, sottile fusione masse bilateralmente |
| D | sicuramente non solido | riassorbimento dell’innesto bilateralmente o massa di fusione con evidente pseudoartrosi bilaterale |
Fusione interbody
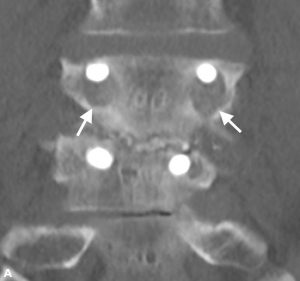
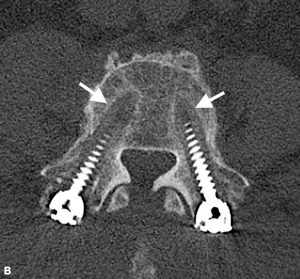
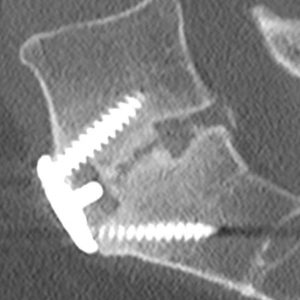
Brantigan e Steffee descrissero per la prima volta una classificazione della fusione interbody attraverso la loro gabbia in fibra di carbonio.43 Successivamente modificato da Fraser, è solitamente noto come classificazione BSF (Brantigan, Steffee, Fraser) (Tabella 4-3).La pseudoartrosi 32,44 viene valutata mediante scansione TC e classificata come BSF-1 dove vi sono segni grossolani di movimento (Fig. 4-2), o BSF-2 dove c’è una lucenza orizzontale attraverso lo spazio intercorpo (Fig. 4-3). Quest’ultimo è solitamente noto come “pseudoartrosi bloccata”. Per quanto riguarda la fusione, consideravano la fusione solida se l’osso era visto crescere attraverso una delle gabbie PLIF, anche se l’altra aveva lucenza attraverso di essa.
| Descrizione | |
| BSF-1 | Radiographical pseudoartrosi è indicato da
|
| BSF-2 | Radiographical bloccato pseudoartrosi è indicato da lucency visibile in il centro delle gabbie con osso solido che cresce nella gabbia da ogni piastra terminale vertebrale. |
| BSF-3 | Fusione radiografica: l’osso collega almeno la metà dell’area di fusione con almeno la densità originariamente raggiunta in chirurgia. |
STRATEGIE CHIRURGICHE
La decisione di offrire un intervento chirurgico deve sempre essere un equilibrio di rischi e benefici. Un paziente asintomatico con pseudoartrosi a livello singolo può non richiedere l’intervento, ma un paziente con una fusione lunga, anche se asintomatica, può giustificare la considerazione per evitare di rendere molto più difficile un intervento chirurgico futuro. Va notato che, anche dopo la fusione di successo, i pazienti che avevano sofferto di una pseudartrosi non lo fanno così come quelli che hanno avuto una fusione di successo dopo il loro intervento chirurgico iniziale.5
Approccio
Le variazioni nel trattamento chirurgico di una pseudartrosi sono tante e varie quanto i metodi di esecuzione di una fusione in primo luogo. I principi generali da seguire sono migliorare la stabilizzazione, eseguire nuovi innesti e ripristinare l’allineamento sagittale.45 Al fine di migliorare la stabilizzazione, è necessario sostituire la strumentazione chiaramente allentata e rotta. Spesso le viti del peduncolo possono essere “upsized” da un millimetro o da due di diametro per raggiungere la buona presa in una traiettoria precedentemente allentata della vite. L’allungamento delle viti a volte è anche possibile, ma richiede un’attenta pianificazione preoperatoria. Estendendo la fissazione ad un segmento adiacente dovrebbe essere considerato particolarmente se è associato con la malattia adiacente del segmento, ma uno deve tenere presente che i livelli recentemente incorporati egualmente devono raggiungere la fusione. In senso pratico, per una fusione lombosacrale fallita, l’estensione della fissazione all’ileo è spesso molto efficace nel migliorare la stabilizzazione.46
L’aggiunta di innesto interbody a una fusione posterolaterale fallita è un mezzo per aggiungere materiale di innesto sotto compressione, oltre a migliorare la stabilizzazione. Sostituendo uno spazio disco “morbido” con una combinazione di gabbia e innesto relativamente più rigida, il supporto della colonna anteriore viene migliorato. A seconda del livello, questo può essere eseguito tramite un approccio anteriore o laterale. Una tecnica TLIF o PLIF può anche essere utilizzato, ma questi molto probabilmente incontrare tessuto cicatriziale e aumentare il rischio di lesioni nervose e lacrime durali.
Equilibrio sagittale
Equilibrio sagittale deve sempre essere misurata e contabilizzata. Un paziente con una pseudartrosi in scarso allineamento sagittale avrà ancora un risultato scadente con una fusione solida se il loro allineamento non viene affrontato. Un’osteotomia attraverso una pseudoartrosi può essere necessaria per ottenere la correzione, ma ancora una volta, il chirurgo deve ottimizzare la possibilità di fusione ottenendo una buona apposizione ossea, costrutti rigidi e forti e migliorando i fattori di rischio del paziente.
Stimolazione
Esistono alcune ricerche per supportare l’uso di stimolatori di corrente continua,47,48 e stimolazione del campo elettromagnetico pulsato.49-51 Sfortunatamente, nessuno dei due metodi ha mostrato risultati costantemente buoni ed è in gran parte caduto fuori uso diffuso.
Innesto osseo
Non esiste un sostituto sintetico per l’innesto di cresta iliaca, e questo dovrebbe sempre essere la fonte di materiale di innesto ogni volta che è disponibile per il trattamento della pseudartrosi. Mentre rhBMP-2 ha dimostrato di essere equivalente all’innesto osseo autologo in due ampie revisioni sistematiche,52,53 non è privo di costi o complicazioni. Gli allotrapianti mancano di proprietà osteoinduttive come la ceramica come il fosfato tricalcico, e quando il chirurgo sta trattando una pseudartrosi, i “riempitivi” biologicamente inerti come questi dovrebbero essere evitati.
CONCLUSIONE
La pseudoartrosi è ancora uno dei problemi più impegnativi per il chirurgo spinale e il rischio di essa dovrebbe essere discusso con tutti i potenziali pazienti di fusione. La minimizzazione dei rischi di pseudartrosi inizia ben prima che il bisturi tocchi la pelle, con le indagini preoperatorie completate, la pianificazione eseguita e tutti i fattori di rischio mitigati.
Qualsiasi paziente fusion che non risponde nel solito modo dovrebbe segnalare al chirurgo la possibilità che si stia sviluppando la pseudartrosi. Il chirurgo che “incolpa” il paziente non rende giustizia al paziente o a se stesso. Le indagini pertinenti includono i raggi X e le scansioni TC; si dovrebbero notare sottili cambiamenti nel tempo.
Una volta stabilita la diagnosi, dovrebbe verificarsi una discussione attenta e aperta sui benefici e sui rischi dell’intervento chirurgico poiché questa decisione non è sempre chiara. Una volta deciso l’intervento chirurgico, il chirurgo deve prendere in considerazione la modalità di guasto e le misure necessarie per ottenere la fusione in un allineamento accettabile. Purtroppo, il corso operativo e postoperatorio non può essere previsto per essere di routine, e si deve consigliare il paziente che potrebbero mai raggiungere il risultato atteso dalla loro operazione indice.
PERLE E INSIDIE
- In pazienti con un alto rischio di sviluppo di pseudartrosi, pianificare e prepararsi a eseguire un intervento chirurgico che attenuerà tali rischi. La strumentazione migliora la velocità di fusione, così come l’esecuzione di fusioni a 360 ° attraverso due approcci separati o con innesti interbody e posterolaterali bilaterali.
- Sospetto che un paziente stia sviluppando una pseudoartrosi se i loro punteggi di risultato funzionale non migliorano come previsto.
- Le ricostruzioni della TAC del piano coronale sono l’indagine di scelta per trovare una pseudartrosi e, in particolare, una “pseudartrosi bloccata.”
- L’allentamento attorno alle viti dovrebbe risolversi con il tempo e dovrebbe essere seguito attentamente, ma la lucenza attorno a una gabbia interbody è probabilmente il precursore di un’eventuale pseudartrosi.
- L’innesto osseo autologo dovrebbe essere il materiale di innesto di scelta.
LETTURA CONSIGLIATA
- Choudhri TF, Mummaneni PV, Dhall SS, et al. Aggiornamento delle linee guida per l’esecuzione delle procedure di fusione per la malattia degenerativa della colonna lombare. Parte 4: valutazione radiografica dello stato di fusione. J Neurochirurgia della colonna vertebrale. 2014;21(1):23-30.
- Lee C, Dorcil J, Radomisli TE. Non unione della colonna vertebrale: una recensione. Clin Orthop Relat Res. 2004;(419):71-75.
- Resnick DK, Choudhri TF, Dailey AT, et al. Linee guida per l’esecuzione di procedure di fusione per la malattia degenerativa della colonna lombare. Parte 4: valutazione radiografica della fusione. J Neurochirurgia della colonna vertebrale. 2005;2(6):653-657.
- Adogwa O, Parker SL, Shau D, et al. Costo per anno di vita corretto per la qualità ottenuto dalla fusione di revisione per pseudoartrosi lombare: definizione del valore della chirurgia. J Disturbo spinale Tech. 2015;28(3):101-105.
- Chun DS, Baker KC, Hsu WK. Pseudartrosi lombare: una revisione della diagnosi e del trattamento attuali. Neurochirurgia Messa a fuoco. 2015; 39(4): E10.
- Raizman NM, O’Brien JR, Poehling-Monaghan KL, Yu WD. Pseudartrosi della colonna vertebrale. J Am Acad Orthop Surg. 2009;17 (8): 494-503.
- Hadley MN, Reddy SV. Il fumo e la colonna vertebrale umana: una revisione dell’impatto dell’uso di sigarette sul metabolismo osseo vertebrale e sulla fusione spinale. Neurochirurgia. 1997;41(1):116-124.
- Gertzbein SD, Hollopeter MR, Hall S. Pseudartrosi della colonna lombare. Risultato dopo la fusione circonferenziale. Vertebrale. 1998;23(21): 2352-2356; discussione 2356-2357.
- Marrone CW, Orme TJ, Richardson HD. Il tasso di pseudartrosi (non unione chirurgica) in pazienti fumatori e pazienti non fumatori: uno studio di confronto. Vertebrale. 1986;11(9):942-943.
- Bydon M, De la Garza-Ramos R, Abt NB, et al. Impatto del fumo sulle complicanze e sui tassi di pseudartrosi dopo fusione posterolaterale a livello singolo e 2 della colonna lombare. Vertebrale. 2014;39(21):1765-1770.
- Jenkins JD, Coric D, Branch CL Jr. Un confronto clinico di fissazione odontoidea a una e due viti. J Neurochirurgia. 1998;89(3):366-370.
- Deguchi M, Rapoff AJ, Zdeblick TA. Fusione posterolaterale per spondilolistesi istmica negli adulti: analisi della velocità di fusione e risultati clinici. J Disturbo spinale. 1998;11(6):459-464.
- Boden SD, Sumner DR. Fattori biologici che influenzano la fusione spinale e la rigenerazione ossea. Vertebrale. 1995;20 (24 Suppl): 102S-112S.
- Bono CM, Lee CK. Analisi critica delle tendenze nella fusione per la malattia degenerativa del disco negli ultimi 20 anni: influenza della tecnica sul tasso di fusione e sull’esito clinico. Vertebrale. 2004; 29 (4):455-463; discussione Z5.
- Zdeblick TA. Uno studio prospettico randomizzato sulla fusione lombare. Risultati preliminari. Vertebrale. 1993;18(8):983-991.
- Nemoto O, Asazuma T, Yato Y, Imabayashi H, Yasuoka H, Fujikawa A. Confronto dei tassi di fusione a seguito di fusione intercorpo lombare transforaminale utilizzando gabbie di polietereterchetone o gabbie di titanio con strumentazione transpedicolare. Eur Spine J. 2014;23(10): 2150-2155.
- Wu SH, Li Y, Zhang YQ, et al. La gabbia porosa del vanadio di titanio-6 alluminio-4 ha migliore osteointegrazione e meno micromozione che una gabbia del poli-etere-etere-chetone nella fusione vertebrale delle pecore. Artif Organi. 2013; 37(12): E191-E201.
- Olivares-Navarrete R, Gittens RA, Schneider JM, et al. Gli osteoblasti presentano un fenotipo più differenziato e una maggiore produzione di proteine morfogenetiche ossee su substrati in lega di titanio rispetto a poli-etere-etere-chetone. Colonna vertebrale J. 2012;12 (3): 265-272.
- Bridwell KH, Lewis SJ, Lenke LG, Baldus C, Blanke K. Osteotomia di sottrazione del peduncolo per il trattamento dello squilibrio sagittale fisso. J osso giunto Surg Am. 2003; 85-A (3): 454-463.
- Dickson DD, Lenke LG, Bridwell KH, Koester LA. Fattori di rischio e valutazione della pseudoartrosi sintomatica dopo osteotomia sottrazione peduncolare lombare nella deformità spinale dell’adulto. Vertebrale. 2014;39(15):1190-1195.
- Deviren V, Tang JA, Scheer JK, et al. Costruire rigidità dopo carico di fatica in osteotomia sottrazione peduncolo con o senza gabbie strutturali intercorpi adiacenti. Spina dorsale globale J. 2012; 2(4): 213-220.le camere sono dotate di TV via cavo con film su richiesta. Risultati radiografici a lungo termine di un costrutto a gancio centrale per la chiusura dell’osteotomia: follow-up minimo di 5 anni. Vertebrale. 2015; 40(7): E428-E432.
- Kim YJ, Bridwell KH, Lenke LG, Rhim S, Cheh G. Pseudartrosi nella deformità spinale adulta lunga strumentazione e fusione al sacro: prevalenza e analisi dei fattori di rischio di 144 casi. Vertebrale. 2006;31(20):2329-2336.
- DePalma AF, Rothman RH. La natura della pseudartrosi. Clin Orthop Relat Res. 1968;59:113-118.
- Kornblum MB, Fischgrund JS, Herkowitz HN, Abraham DA, Berkower DL, Ditkoff JS. Spondilolistesi lombare degenerativa con stenosi spinale: uno studio prospettico a lungo termine che confronta fusione e pseudartrosi. Vertebrale. 2004; 29(7): 726-733; discussione 733-734.
- Resnick DK, Choudhri TF, Dailey AT, et al. Linee guida per l’esecuzione di procedure di fusione per la malattia degenerativa della colonna lombare. Parte 5: correlazione tra risultato radiografico e funzionale. J Neurochirurgia della colonna vertebrale. 2005;2(6):658-661.
- Klineberg E, Gupta M, McCarthy I, Hostin R. Rilevamento della pseudoartrosi nella deformità spinale adulta: l’uso di risultati di qualità della vita correlati alla salute per predire la pseudoartrosi. Clin Spine Surg. 2016;29 (8): 318-322.
- Landis JR, Koch GG. La misurazione dell’accordo osservatore per i dati categoriali. Biometria. 1977;33(1):159-174.
- Brodsky AE, Kovalsky ES, Khalil MA. Correlazione della valutazione radiologica delle fusioni della colonna lombare con l’esplorazione chirurgica. Vertebrale. 1991;16 (6 Suppl): S261-S265.
- Kant AP, Daum WJ, Dean SM, Uchida T. Valutazione della fusione della colonna lombare. Radiografie semplici contro l’esplorazione chirurgica diretta e l’osservazione. Vertebrale. 1995;20(21):2313-2317.
- Carreon LY, Djurasovic M, Glassman SD, Sailer P. Accuratezza diagnostica e affidabilità delle TAC a taglio fine con ricostruzioni per determinare lo stato di una fusione posterolaterale strumentata con esplorazione chirurgica come standard di riferimento. Vertebrale. 2007;32(8):892-895.
- Carreon LY, Glassman SD, Schwender JD, Subach BR, Gornet MF, Ohno S. Affidabilità e precisione delle scansioni di tomografia computerizzata a taglio fine per determinare lo stato delle fusioni interbody anteriori con gabbie metalliche. Colonna vertebrale J. 2008; 8(6): 998-1002.per saperne di più Gabbie di fusione tra corpi in operazioni ricostruttive sulla colonna vertebrale. J osso giunto Surg Am. 1999;81(6):859-880.
- Shah RR, Mohammed S, Saifuddin A, Taylor BA. Confronto di radiografie semplici con TAC per valutare la fusione inter-corporea a seguito dell’utilizzo di gabbie inter-corporee in titanio e strumentazione transpedicolare. Eur Spine J. 2003; 12(4): 378-385.
- Fogel GR, Toohey JS, Neidre A, Brantigan JW. Fusion valutazione della fusione intercorpo lombare posteriore mediante gabbie radiotrasparenti: film a raggi X e scansioni di tomografia computerizzata elicoidale rispetto all’esplorazione chirurgica della fusione. Colonna vertebrale J. 2008; 8 (4): 570-577.
- Kanemura T, Matsumoto A, Ishikawa Y, et al. Cambiamenti radiografici in pazienti con pseudoartrosi dopo artrodesi interbody lombare posteriore utilizzando gabbie interbody carbonio: uno studio prospettico di cinque anni. J osso giunto Surg Am. 2014; 96(10): e82.
- Kröner AH, Eyb R, Lange A, Lomoschitz K, Mahdi T, Engel A. Valutazione della risonanza magnetica della fusione intercorpo lombare posteriore. Vertebrale. 2006;31(12):1365-1371.
- Lang P, Chafetz N, Genant HK, Morris JM. Fusione spinale lombare. Valutazione della stabilità funzionale con risonanza magnetica. Vertebrale. 1990;15(6):581-588.
- Johnsson R, Selvik G, Strömqvist B, Sundén G. Mobilità della colonna lombare inferiore dopo fusione posterolaterale determinata dall’analisi stereofotogrammetrica di roentgen. Vertebrale. 1990;15(5):347-350.
- Johnsson R, Axelsson P, Gunnarsson G, Strömqvist B. Stabilità della fusione lombare con fissazione transpedicolare determinata dall’analisi stereofotogrammetrica di roentgen. Vertebrale. 1999;24(7):687-690.
- Bohnsack M, Gossé F, Rühmann O, Wenger K. Il valore della scintigrafia nella diagnosi di pseudartrosi dopo chirurgia di fusione spinale. J Disturbo spinale. 1999;12(6):482-484.
- McMaster MJ, Merrick MV. La valutazione scintigrafica della colonna scoliotica dopo la fusione. J Bone Joint Surg Br. 1980; 62-B (1): 65-72.
- Jacobson JA, Starok M, Pathria MN, Garfin SR. Pseudartrosi: valutazione degli Stati Uniti dopo fusione spinale posterolaterale: lavori in corso. Radiologico. 1997;204(3):853-858.
- Heggeness MH, Esses SI. Classificazione delle pseudartrosi della colonna lombare. Vertebrale. 1991;16 (8 Suppl): S449-S454.
- Lenke LG, Bridwell KH, Bullis D, Betz RR, Baldus C, Schoenecker PL. Risultati della fusione in situ per spondilolistesi istmica. J Disturbo spinale. 1992;5(4):433-442.
- Brantigan JW, Steffee AD. Un impianto in fibra di carbonio per aiutare la fusione lombare interbody. Risultati clinici di due anni nei primi 26 pazienti. Vertebrale. 1993;18(14):2106-2107.
- Santos ER, Goss DG, Morcom RK, Fraser RD. Valutazione radiologica della fusione inter-corporea mediante gabbie in fibra di carbonio. Vertebrale. 2003;28(10):997-1001.
- Larsen J, Capen DA. Pseudartrosi della colonna lombare. J Am Acad Orthop Surg. 1997;5 (3): 153-162.il sito utilizza cookie tecnici e di terze parti. Analisi minima di 2 anni della fissazione sacropelvica e della fusione L5-S1 con viti S1 e screwsache. Vertebrale. 2001;26(18):1976-1983.
- Tejano NA, Puno R, Ignacio JM. L’uso della stimolazione a corrente continua impiantabile nella fusione spinale multilivello senza strumentazione. Una valutazione prospettica clinica e radiografica con follow-up a lungo termine. Vertebrale. 1996;21(16):1904-1908.il nostro sito utilizza cookie tecnici e di terze parti. Uno studio in doppio cieco della stimolazione elettrica accoppiata capacitivamente in aggiunta alle fusioni spinali lombari. Vertebrale. 1999; 24 (13): 1349-1356; discussione 1357.
- Hodges SD, Eck JC, Humphreys SC. Uso della stimolazione ossea elettrica nella fusione spinale. J Am Acad Orthop Surg. 2003;11 (2): 81-88.
- Simmons JW. Trattamento della fusione intercorpo lombare posteriore fallita (PLIF) della colonna vertebrale con campi elettromagnetici pulsanti. Clin Orthop Relat Res. 1985;(193):127-132.
- Simmons JW Jr, Mooney V, Thacker I. Pseudartrosi dopo fusione della colonna lombare: salvataggio non operatorio con campi elettromagnetici pulsati. Am J Orthop. 2004;33(1):27-30.
- Simmonds MC, Brown JV, Eredi MK, et al. Sicurezza ed efficacia della proteina morfogenetica ossea umana ricombinante-2 per la fusione spinale: una meta-analisi dei dati del singolo partecipante. Ann Stagista Med. 2013;158(12):877-889.
- Fu R, Selph S, McDonagh M, et al. Efficacia e danni della proteina morfogenetica ossea umana ricombinante-2 nella fusione della colonna vertebrale: una revisione sistematica e meta-analisi. Ann Stagista Med. 2013;158(12):890-902.