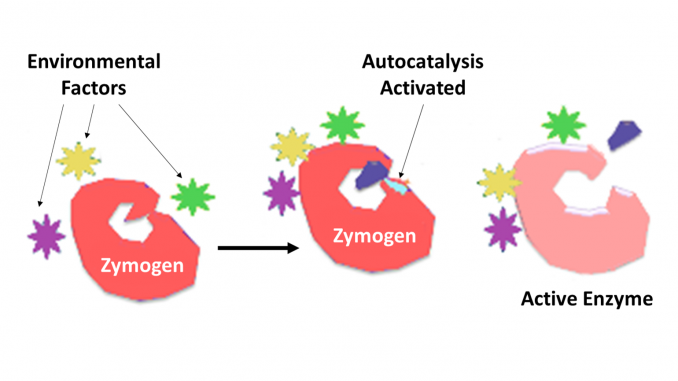
Zymogen, také volal proenzym, žádné skupiny proteinů, které nevykazují katalytickou aktivitu, ale jsou transformovány v organismu na enzymy, zejména ty, které katalyzují reakce, při nichž dochází k odbourávání bílkovin. Biochemická změna se obvykle vyskytuje v Golgiho tělech, kde se štěpí specifická část prekurzorového enzymu, aby se aktivovala. Na inaktivaci kus, který je štěpen off může být peptid jednotka, nebo může být nezávisle skládací domény obsahující více než 100 zbytků. I když omezují schopnost enzymu, tato n-koncová rozšíření enzymu nebo „prosegment“ často pomáhají při stabilizaci a skládání enzymu, který inhibují.
nyní je dobře známo, že proteolytické enzymy hrají klíčovou roli při regulaci nebo kontrole působení jiných proteinů. Tyto enzymy se nacházejí ve všech druhů, od bakterií až po člověka a v ovládání různých systémů, které zahrnují produkci hormonů, bakteriofág montáž, vývoj, hnojení, trávení, obrana proti invazní organismy, a opravu tkání. Ve většině případů je známo, že proteolytické enzymy jsou syntetizovány jako neaktivní prekurzorové proenzymy nebo zymogeny. Aktivují se proteolytickým štěpením jediné peptidové vazby v proenzymu a stávají se tak katalyticky aktivními. Další kontrola stupně specificity pro cílovou molekulu nebo molekuly je určena stupněm specificity vlastní enzymu. Další kontrola času a místa působení se často provádí proteinovými inhibitory požadované specificity.
struktura trypsinogen je obecně mnohem blíže k trypsin, než je chymotrypsinogen na chymotrypsin, struktura trypsinogen nevylučuje možnost substrátu závazné v režimu podobné, že našel pro trypsin, i když změny ve struktuře tohoto regionu přispívají ke zhoršené nebo změněn podklad závazný režim-rozhodně pro benzamidine a pravděpodobně na podkladu postranní řetězec, Pokud proenzym je považován za rigidní, pak obecné základní katalyzátor a oxyanion vazebné místo tvořené N-H skupiny Gly193 a Ser195 jsou příliš daleko od sebe spolupracovat při hydrolýze substrátu. I když proenzym strukturu změnit na substrátu závazné, což se jeví jako pravděpodobné, neproduktivní vazba může poskytnout další důležitou složkou pro zymogen nečinnosti. Taková vazba může stále zanechat příliš velkou vzdálenost nebo nepříznivou interakci mezi substrátem a prvky katalytického centra. Změněné postavení řetězce mezi Lys188A a Ser195 a hlavní řetězce mezi Trp215 a Ser217 by mohl být odpovědný za konkurenční, ale neproduktivní substrátu závazné, jako by na N-H skupině Gly193, protože jsou obvykle zapojeny v orientaci substrátu. Tyto možnosti rematin jako hlavní kandidáti v univerzálním schématu pro nečinnost zymogenů podobných trypsinogenu.
pankreas vylučuje zymogeny částečně, aby zabránil enzymům v trávení proteinů v buňkách, ve kterých jsou syntetizovány. Enzymy jako pepsin jsou vytvářeny ve formě pepsinogenu, neaktivního zymogenu. Pepsinogen se aktivuje, když ho hlavní buňky uvolňují do žaludeční kyseliny, jejíž kyselina chlorovodíková jej částečně aktivuje. Další částečně aktivovaný pepsinogen dokončí aktivaci odstraněním peptidu a přeměnou pepsinogenu na pepsin. Náhodná aktivace zymogenů může nastat, když je sekreční kanál v pankreatu blokován žlučovým kamenem, což vede k akutní pankreatitidě.
houby také vylučují trávicí enzymy do životního prostředí jako zymogeny. Vnější prostředí má jiné pH než uvnitř houbové buňky, což mění strukturu zymogenu na aktivní enzym.
dalším způsobem, jak mohou enzymy existovat v neaktivních formách a později být přeměněny na aktivní formy, je aktivace pouze tehdy, když je vázán kofaktor, nazývaný koenzym. V tomto systému se neaktivní forma (apoenzym) stává aktivní formou (holoenzym), když se koenzym váže.