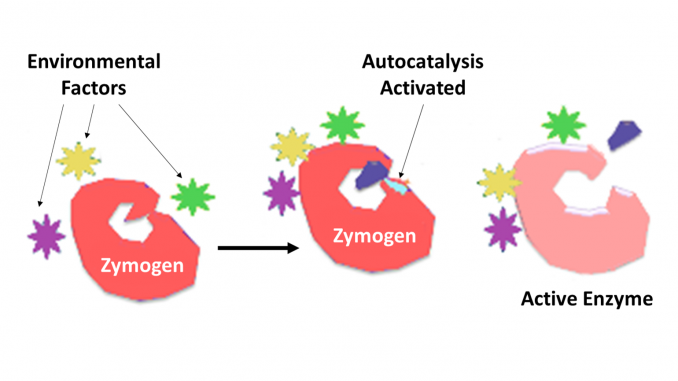
a zymogen, más néven proenzim, bármely olyan fehérjecsoport, amely nem mutat katalitikus aktivitást, de egy szervezetben enzimekké alakul át, különösen azok, amelyek katalizálja a fehérjék lebontásával járó reakciókat. A biokémiai változás általában a Golgi-testekben fordul elő, ahol a prekurzor enzim egy meghatározott részét hasítják annak aktiválása érdekében. A lehasított inaktiváló darab lehet peptidegység, vagy lehet egymástól függetlenül összehajtható domén, amely több mint 100 maradékot tartalmaz. Bár korlátozzák az enzim képességét, az enzim ezen n-terminális kiterjesztései vagy egy” prosegment ” gyakran segítik az általuk gátolt enzim stabilizálását és összehajtását.
ma már jól ismert, hogy a proteolitikus enzimek kulcsszerepet játszanak más fehérjék szabályozásában vagy ellenőrzésében. Az ilyen enzimek minden fajban megtalálhatók a baktériumoktól az emberig, és különböző rendszerek irányításában, amelyek magukban foglalják a hormontermelést, a bakteriofág összeszerelését, a fejlődést, a megtermékenyítést, az emésztést, a behatoló szervezetek elleni védelmet és a szövetek helyreállítását. A legtöbb esetben a proteolitikus enzimekről ismert, hogy inaktív prekurzor proenzimként vagy zimogénként szintetizálódnak. A proenzimben egyetlen peptidkötés proteolitikus hasításával aktiválódnak, így katalitikusan aktívvá válnak. A célmolekula vagy molekulák specifitásának további ellenőrzését az enzimre jellemző specifitás mértéke határozza meg. A hatás idejének és helyének további ellenőrzését gyakran a szükséges specifitású fehérje inhibitorok végzik.
a tripszinogén szerkezete általában sokkal közelebb áll a tripszin szerkezetéhez, mint a kimotripszinogén a kimotripszinhez, a tripszinogén szerkezete nem zárja ki a szubsztrát kötődésének lehetőségét a tripszinhez hasonló módban, bár ennek a régiónak a szerkezetében bekövetkező változások hozzájárulnak a károsodott vagy megváltozott szubsztrátkötési módhoz-természetesen a benzamidin és valószínűleg egy szubsztrát oldallánc esetében, ha a proenzimet merevnek tekintik, akkor az Általános báziskatalizátor és az oxianion kötőhelye kialakult az n-h csoportok szerint a Gly193 és a ser195 túl messze vannak egymástól a szubsztrát hidrolízisében való együttműködés. Még akkor is, ha a proenzim szerkezete megváltozna a szubsztrátkötésnél, mint valószínűnek tűnik, a nem produktív kötés a zymogen inaktivitásának másik fontos összetevőjét szolgáltathatja. Az ilyen kötés még mindig túl nagy távolságot vagy kedvezőtlen kölcsönhatást hagyhat a szubsztrát és a katalitikus központ elemei között. A Lys188A és a Ser195 közötti lánc megváltozott helyzete, valamint a trp215 és a Ser217 közötti fő lánc felelős lehet a versenyképes, mégis nem produktív szubsztrátkötésért, csakúgy, mint a Gly193 N-H csoportja, mivel általában részt vesznek a szubsztrát orientálásában. Ezek a lehetőségek rematin mint elsődleges jelöltek a tripszinogén-szerű zimogének inaktivitásának univerzális sémájában.
a hasnyálmirigy részben kiválasztja a zimogéneket, hogy megakadályozza az enzimeket a fehérjék emésztésében azokban a sejtekben, amelyekben szintetizálódnak. Az olyan enzimek, mint a pepszin, pepszinogén, inaktív zimogén formájában jönnek létre. A pepszinogén akkor aktiválódik, amikor a fő sejtek felszabadítják a gyomorsavba, amelynek sósavja részben aktiválja. Egy másik részlegesen aktivált pepszinogén befejezi az aktiválást a peptid eltávolításával, a pepszinogént pepszinné alakítva. A zimogének véletlen aktiválása akkor fordulhat elő, ha a hasnyálmirigy szekréciós csatornáját egy epekő blokkolja, ami akut pancreatitist eredményez.
a gombák emésztőenzimeket is kiválasztanak a környezetbe, mint zimogének. A külső környezet pH-ja más, mint a gombasejt belsejében, és ez megváltoztatja a zimogén szerkezetét aktív enzimgé.
az enzimek inaktív formában létezhetnek, majd később aktív formákká alakulhatnak, ha csak akkor aktiválódnak, ha egy koenzimnek nevezett kofaktor kötődik. Ebben a rendszerben az inaktív forma (az apoenzim) aktív formává válik (a holoenzim), amikor a koenzim kötődik.