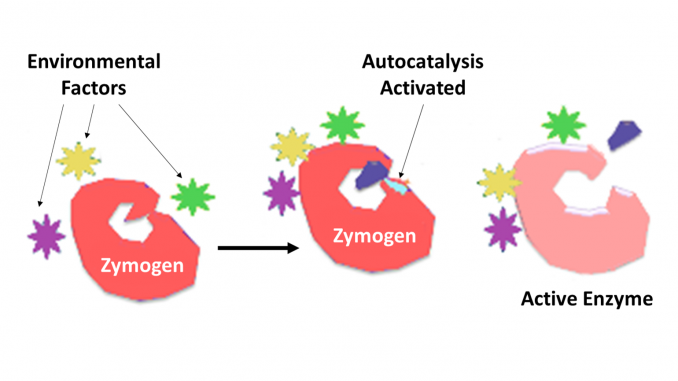
Zymogen, également appelé proenzyme, fait partie d’un groupe de protéines qui ne présentent aucune activité catalytique mais sont transformées au sein d’un organisme en enzymes, en particulier celles qui catalysent réactions impliquant la dégradation des protéines. Le changement biochimique se produit généralement dans les corps de Golgi, où une partie spécifique de l’enzyme précurseur est clivée afin de l’activer. La pièce inactivante clivée peut être une unité peptidique, ou peut être des domaines repliables indépendamment comprenant plus de 100 résidus. Bien qu’elles limitent la capacité de l’enzyme, ces extensions n-terminales de l’enzyme ou un « prosegment” aident souvent à la stabilisation et au repliement de l’enzyme qu’elles inhibent.
Il est maintenant bien reconnu que les enzymes protéolytiques jouent un rôle clé dans la régulation ou le contrôle de l’action d’autres protéines. De telles enzymes peuvent être trouvées chez toutes les espèces, des bactéries à l’homme, et dans le contrôle de divers systèmes, notamment la production d’hormones, l’assemblage de bactériophages, le développement, la fertilisation, la digestion, la défense contre les organismes envahissants et la réparation des tissus. Dans la plupart des cas, les enzymes protéolytiques sont connues pour être synthétisées sous forme de proenzymes précurseurs inactifs, ou zymogènes. Ils sont activés par le clivage protéolytique d’une liaison peptidique unique dans la proenzyme et deviennent ainsi catalytiquement actifs. Un contrôle supplémentaire du degré de spécificité d’une ou de plusieurs molécules cibles est déterminé par le degré de spécificité inhérent à l’enzyme. Un contrôle supplémentaire du temps et du lieu d’action est souvent effectué par des inhibiteurs de protéines de la spécificité requise.
La structure du trypsinogène est généralement beaucoup plus proche de celle de la trypsine que la chymotrypsinogène de la chymotrypsine, La structure du trypsinogène n’exclut pas la possibilité de se lier au substrat dans un mode similaire à celui trouvé pour la trypsine, bien que des changements dans la structure de cette région contribuent à un mode de liaison au substrat altéré ou altéré – certainement pour la benzamidine et très probablement pour une chaîne latérale du substrat, Si la proenzyme est considérée comme rigide, alors le catalyseur de base général et le site de liaison à l’oxyanion formé par le N- Les groupes H de Gly193 et Ser195 sont trop éloignés les uns des autres coopérer à l’hydrolyse du substrat. Même si la structure de la proenzyme devait changer lors de la liaison au substrat, comme cela semble probable, une liaison non productive pourrait fournir un autre composant important pour l’inactivité du zymogène. Une telle liaison peut encore laisser une distance trop importante, ou une interaction défavorable, entre le substrat et les éléments du centre catalytique. La position altérée de la chaîne entre Lys188A et Ser195 et de la chaîne principale entre Trp215 et Ser217 pourrait être responsable de la liaison compétitive mais non productive du substrat, tout comme le groupe N-H de Gly193 puisqu’ils sont normalement impliqués dans l’orientation du substrat. Ces possibilités se rematin en tant que candidats principaux dans un schéma universel d’inactivité des zymogènes de type trypsinogène.
Le pancréas sécrète des zymogènes en partie pour empêcher les enzymes de digérer les protéines dans les cellules dans lesquelles elles sont synthétisées. Des enzymes comme la pepsine sont créées sous forme de pepsinogène, un zymogène inactif. Le pepsinogène est activé lorsque les cellules principales le libèrent dans l’acide gastrique, dont l’acide chlorhydrique l’active partiellement. Un autre pepsinogène partiellement activé complète l’activation en éliminant le peptide, transformant le pepsinogène en pepsine. L’activation accidentelle des zymogènes peut se produire lorsque le canal de sécrétion du pancréas est bloqué par un calcul biliaire entraînant une pancréatite aiguë.
Les champignons sécrètent également des enzymes digestives dans l’environnement sous forme de zymogènes. L’environnement externe a un pH différent de celui à l’intérieur de la cellule fongique, ce qui transforme la structure du zymogène en une enzyme active.
Une autre façon dont les enzymes peuvent exister sous des formes inactives et ensuite être converties en formes actives consiste à s’activer uniquement lorsqu’un cofacteur, appelé coenzyme, est lié. Dans ce système, la forme inactive (l’apoenzyme) devient la forme active (l’holoenzyme) lorsque la coenzyme se lie.