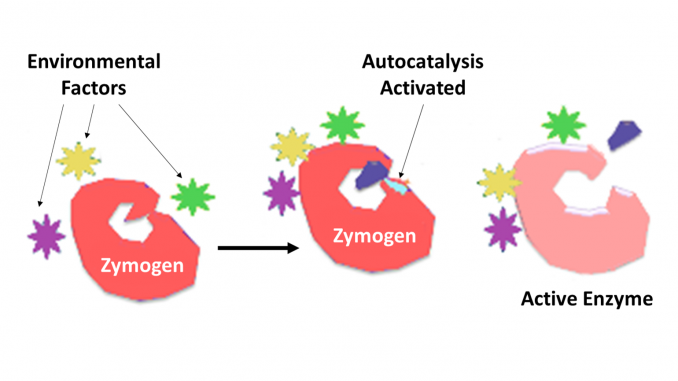
Zymogen, også kalt proenzym, noen av en gruppe proteiner som ikke viser katalytisk aktivitet, men er transformert i en organisme til enzymer, spesielt de som katalysere Reaksjoner Som Involverer Nedbrytning av proteiner. Den biokjemiske forandringen skjer vanligvis I Golgi-legemer, hvor en bestemt del av forløperenzymet spaltes for å aktivere det. Det inaktiverende stykket som spaltes av, kan være en peptidenhet, eller kan være uavhengig folding domener som omfatter mer enn 100 rester. Selv om de begrenser enzymets evne, hjelper disse n-terminale forlengelsene av enzymet eller en «prosegment» ofte til stabilisering og folding av enzymet de hemmer.det er nå velkjent at proteolytiske enzymer spiller nøkkelroller i reguleringen av eller kontrollen over virkningen av andre proteiner. Slike enzymer kan finnes i alle arter fra bakterier til mennesker og i kontroll av ulike systemer, som inkluderer hormonproduksjon, bakteriofagmontering, utvikling, befruktning, fordøyelse, forsvar mot invaderende organismer og vevsreparasjon. I de fleste tilfeller er proteolytiske enzymer kjent for å bli syntetisert som inaktive forløperproenzymer eller zymogener. De aktiveres ved proteolytisk spaltning av en enkelt peptidbinding i proenzymet og blir så katalytisk aktiv. Videre kontroll over graden av spesifisitet for et målmolekyl eller molekyler bestemmes av graden av spesifisitet som er iboende for enzymet. Videre kontroll over tid og sted for handling utføres ofte av proteinhemmere av den nødvendige spesifisiteten.strukturen av trypsinogen utelukker ikke muligheten for substratbinding i en modus som ligner den som finnes for trypsin, selv om endringer i strukturen i denne regionen bidrar til en nedsatt eller endret substratbindingsmodus-sikkert for benzamidin Og sannsynligvis for en substratsidekjede, Hvis proenzymet anses å være stivt, så er den generelle basekatalysatoren og oksyanionbindingsstedet dannet av N-H. grupper av gly193 og ser195 er for langt fra hverandre å samarbeide i substrathydrolyse. Selv om proenzymstrukturen skulle endre seg på substratbinding, som synes sannsynlig, kan ikke-produktiv binding gi en annen viktig komponent for zymogen inaktivitet. En slik binding kan fortsatt etterlate for stor avstand, eller en ugunstig interaksjon, mellom substratet og elementene i katalytisk senter. Den endrede posisjonen til kjeden Mellom Lys188A Og Ser195 og hovedkjeden Mellom Trp215 og Ser217 kan være ansvarlig for konkurransedyktig, men ikke-produktiv substratbinding, og Det samme kan Nh-gruppen Av Gly193 siden de normalt er involvert i å orientere substratet. Disse mulighetene rematin som prime kandidater i en universell ordning for inaktivitet av trypsinogen-lignende zymogens.bukspyttkjertelen utskiller zymogener delvis for å hindre at enzymer fordøyer proteiner i cellene der de syntetiseres. Enzymer som pepsin er opprettet i form av pepsinogen, et inaktivt zymogen. Pepsinogen aktiveres når hovedceller frigjør det i magesyren, hvis saltsyre delvis aktiverer den. En annen delvis aktivert pepsinogen fullfører aktiveringen ved å fjerne peptidet, snu pepsinogen til pepsin. Utilsiktet aktivering av zymogener kan skje når sekresjonskanalen i bukspyttkjertelen er blokkert av en gallestein som resulterer i akutt pankreatitt.
Svampe utskiller også fordøyelsesenzymer i miljøet som zymogener. Det ytre miljøet har en annen pH enn inne i soppcellen, og dette endrer zymogens struktur til et aktivt enzym.en annen måte at enzymer kan eksistere i inaktive former og senere omdannes til aktive former, er ved å aktivere bare når en kofaktor, kalt et koenzym, er bundet. I dette systemet blir den inaktive formen (apoenzymet) den aktive formen (holoenzymet) når koenzymet binder seg.