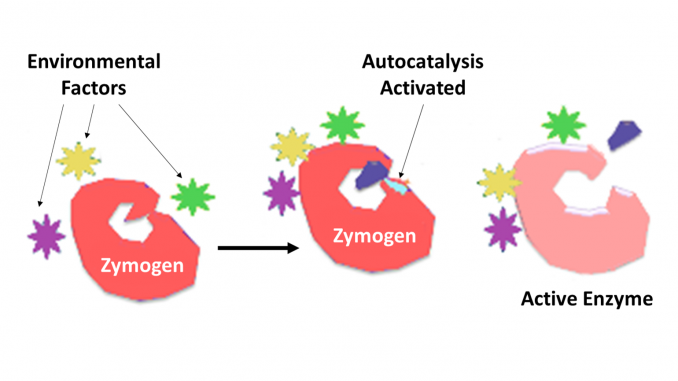
Zymogen, zwany także proenzymem, każde z grupy białek, które nie wykazują aktywności katalitycznej, ale są przekształcane w organizmie w enzymy, zwłaszcza te, które katalizują reakcje polegające na Rozpadie białek. Zmiana biochemiczna Zwykle zachodzi w ciałach Golgiego, gdzie oddzielana jest określona część enzymu prekursorowego w celu jego aktywacji. Odcinany fragment inaktywujący może być jednostką peptydową lub mogą być niezależnie składanymi domenami zawierającymi więcej niż 100 reszt. Chociaż ograniczają zdolność enzymu, te N-końcowe rozszerzenia enzymu lub „prosegment” często pomagają w stabilizacji i fałdowaniu enzymu, który hamują.
obecnie wiadomo, że enzymy proteolityczne odgrywają kluczową rolę w regulacji lub kontroli działania innych białek. Takie enzymy można znaleźć u wszystkich gatunków, od bakterii po człowieka i w kontroli różnych systemów, które obejmują produkcję hormonów, montaż bakteriofagów, rozwój, zapłodnienie, trawienie, obronę przed inwazyjnymi organizmami i naprawę tkanek. W większości przypadków wiadomo, że enzymy proteolityczne są syntetyzowane jako nieaktywne proenzymy prekursorowe lub zymogeny. Są one aktywowane przez proteolityczne rozszczepienie pojedynczego wiązania peptydowego w proenzymie i w ten sposób stają się aktywne katalitycznie. Dalsza kontrola nad stopniem swoistości dla docelowej cząsteczki lub cząsteczek jest określana przez stopień swoistości właściwy enzymowi. Dalsza kontrola nad czasem i miejscem działania jest często przeprowadzana przez inhibitory białek o wymaganej swoistości.
struktura trypsynogenu jest na ogół znacznie bliższa strukturze trypsyny niż chymotrypsynogenu chymotrypsyny, struktura trypsynogenu nie wyklucza możliwości wiązania substratu w trybie podobnym do tego znalezionego dla trypsyny, chociaż zmiany w strukturze tego regionu przyczyniają się do upośledzenia lub zmiany trybu wiązania substratu-z pewnością dla benzamidyny i najprawdopodobniej dla łańcucha bocznego substratu, jeśli proenzym jest uważany za sztywny, to ogólny katalizator zasadowy i miejsce wiązania oksyanionu utworzone przez N-grupy H gly193 i ser195 są zbyt daleko od siebie do współpracy w hydrolizie substratów. Nawet jeśli struktura proenzymu zmieniłaby się na wiązaniu substratu, jak się wydaje prawdopodobne, Wiązanie nieproduktywne może stanowić inny ważny składnik bezczynności zymogenu. Takie wiązanie może pozostawić zbyt dużą odległość lub niekorzystne oddziaływanie między podłożem a elementami centrum katalitycznego. Zmienione położenie łańcucha między Lys188A i Ser195 oraz głównego łańcucha między Trp215 i Ser217 może być odpowiedzialne za konkurencyjne, ale nieproduktywne Wiązanie substratu, podobnie jak grupa n-H Gli193, ponieważ zwykle biorą udział w orientacji substratu. Te możliwości rematin jako prime candidates w uniwersalnym schemacie bezczynności Trypsynogen-like zymogens.
trzustka wydziela zymogeny częściowo, aby zapobiec trawieniu przez enzymy białek w komórkach, w których są syntetyzowane. Enzymy takie jak pepsyna powstają w postaci pepsynogenu, nieaktywnego zymogenu. Pepsynogen jest aktywowany, gdy główne komórki uwalniają go do kwasu żołądkowego, którego kwas solny częściowo go aktywuje. Inny częściowo aktywowany pepsynogen kończy aktywację przez usunięcie peptydu, przekształcając pepsynogen w pepsynę. Przypadkowa aktywacja zymogens może mieć miejsce, gdy przewód wydzielniczy trzustki jest zablokowany przez kamicę żółciową, co prowadzi do ostrego zapalenia trzustki.
Grzyby wydzielają do środowiska także enzymy trawienne jako zymogeny. Środowisko zewnętrzne ma inne pH niż wewnątrz komórki grzyba, co zmienia strukturę zymogenu w aktywny enzym.
innym sposobem, w jaki enzymy mogą istnieć w postaci nieaktywnej, a później być przekształcane w formy aktywne, jest aktywacja tylko wtedy, gdy kofaktor, zwany koenzymem, jest związany. W tym systemie forma nieaktywna (apoenzym) staje się formą aktywną (holoenzym), gdy koenzym wiąże się.