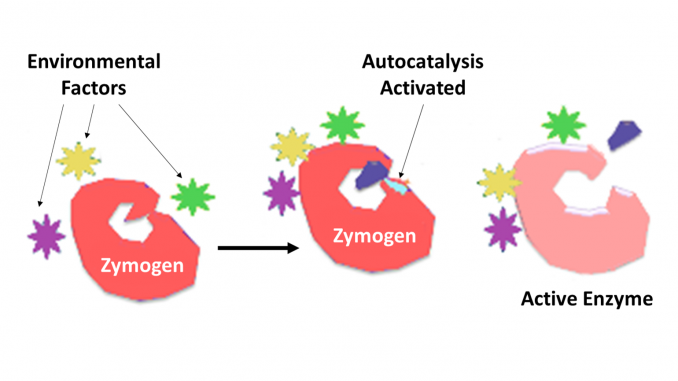
Zymogen, também chamado de proenzyme, qualquer um de um grupo de proteínas que apresentam nenhuma atividade catalítica, mas são transformados no interior de um organismo em enzimas, especialmente aqueles que catalisam reações que envolvem a decomposição de proteínas. A mudança bioquímica geralmente ocorre em corpos de Golgi, onde uma parte específica da enzima precursora é clivada a fim de ativá-la. A peça inactiva que é clivada pode ser uma unidade peptídica, ou pode ser domínios de dobragem independente compreendendo mais de 100 resíduos. Embora limitem a capacidade da enzima, estas extensões n-terminais da enzima ou um “prosegment” muitas vezes ajudam na estabilização e dobragem da enzima que inibem.
é agora bem reconhecido que as enzimas proteolíticas desempenham papéis-chave na regulação ou controlo da acção de outras proteínas. Tais enzimas podem ser encontradas em todas as espécies, desde bactérias ao homem e no controle de diversos sistemas, que incluem a produção de hormônios, montagem bacteriofágica, desenvolvimento, fertilização, digestão, defesa contra organismos invasores, e reparação de tecidos. Na maioria dos casos, sabe-se que as enzimas proteolíticas são sintetizadas como proenzimas precursoras inativas, ou zimógenos. Eles são ativados pela clivagem proteolítica de uma única ligação peptídica na proenzima e assim tornam-se cataliticamente ativos. O controle adicional sobre o grau de especificidade de uma molécula ou moléculas alvo é determinado pelo grau de especificidade inerente à enzima. Um maior controlo sobre o tempo e o local de acção é frequentemente efectuado por inibidores proteicos da especificidade requerida.
A estrutura de tripsinogênio é, geralmente, muito mais próxima da de tripsina que é chymotrypsinogen a quimotripsina, A estrutura de tripsinogênio não exclui a possibilidade de substrato de ligação de modo semelhante ao encontrado para a tripsina, apesar de as alterações na estrutura da região, contribuir para uma diminuída ou alterada substrato modo de ligação-certamente para benzamidine e mais provavelmente por um substrato de cadeia lateral, Se o proenzyme é considerada rígida, em seguida, o general da base de dados de catalisador e o oxyanion sítio de ligação formada pelos N-H de grupos de Gly193 e Ser195 são muito longe cooperar na hidrólise do substrato. Mesmo que a estrutura da proenzima mude na ligação ao substrato, como parece provável, a ligação não produtiva pode constituir outro componente importante para a inactividade do zymogen. Essa ligação ainda pode deixar uma distância muito grande, ou uma interação desfavorável, entre o substrato e os elementos do centro catalítico. A posição alterada da cadeia Entre Lys188A e Ser195 e a cadeia principal entre Trp215 e Ser217 poderia ser responsável pela ligação competitiva mas não produtiva do substrato, assim como o grupo N-H de Gly193, uma vez que estão normalmente envolvidos na orientação do substrato. Estas possibilidades rematin como candidatos principais em um esquema universal para a inatividade dos zimógenos do tipo tripsinogênio.
O pâncreas segrega zimogénios em parte para impedir que as enzimas digerem proteínas nas células em que são sintetizadas. Enzimas como a pepsina são criadas na forma de pepsinogénio, um zimogénio inactivo. O pepsinogénio é activado quando as células principais o libertam no ácido gástrico, cujo ácido clorídrico o activa parcialmente. Outro pepsinogênio parcialmente ativado completa a ativação, removendo o peptídeo, transformando o pepsinogênio em pepsina. A activação acidental de zimogénios pode ocorrer quando o ducto de secreção no pâncreas é bloqueado por um cálculo biliar, resultando em pancreatite aguda.os fungos também segregam enzimas digestivas no ambiente como zimogénios. O ambiente externo tem um pH diferente do que dentro da célula fúngica e isso muda a estrutura do zymogen em uma enzima ativa.
outra forma de as enzimas poderem existir em formas inactivas e posteriormente serem convertidas em formas activas é activando apenas quando um cofactor, chamado de coenzima, se liga. Neste sistema, a forma inactiva (a apoenzima) torna-se a forma activa (a holoenzima) quando a coenzima se liga.