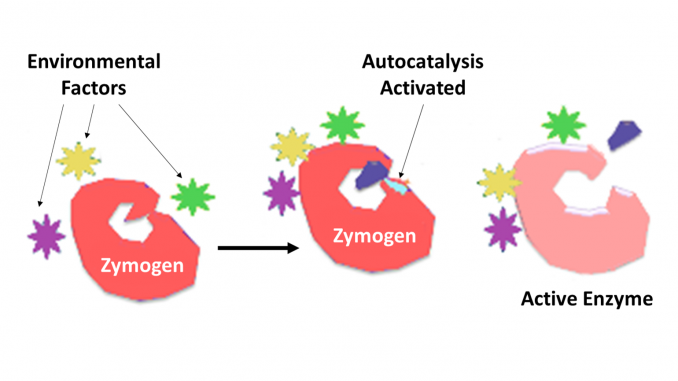
Zymogen, auch Proenzym genannt, gehört zu einer Gruppe von Proteinen, die keine katalytische Aktivität aufweisen, aber innerhalb eines Organismus in Enzyme umgewandelt werden, insbesondere solche, die Reaktionen katalysieren, bei denen Proteine abgebaut werden. Die biochemische Veränderung tritt normalerweise in Golgi-Körpern auf, wo ein bestimmter Teil des Vorläuferenzyms gespalten wird, um es zu aktivieren. Das abgespaltene inaktivierende Stück kann eine Peptideinheit sein oder unabhängig voneinander Faltungsdomänen mit mehr als 100 Resten sein. Obwohl sie die Fähigkeit des Enzyms einschränken, helfen diese n-terminalen Erweiterungen des Enzyms oder eines „Prosegments“ oft bei der Stabilisierung und Faltung des Enzyms, das sie hemmen.Es ist mittlerweile bekannt, dass proteolytische Enzyme eine Schlüsselrolle bei der Regulation oder Kontrolle der Wirkung anderer Proteine spielen. Solche Enzyme können in allen Arten von Bakterien bis zum Menschen und bei der Kontrolle verschiedener Systeme gefunden werden, die Hormonproduktion, Bakteriophagenaufbau, Entwicklung, Befruchtung, Verdauung, Abwehr gegen eindringende Organismen und Gewebereparatur umfassen. In den meisten Fällen ist bekannt, dass die proteolytischen Enzyme als inaktive Vorläuferproenzyme oder Zymogene synthetisiert werden. Sie werden durch proteolytische Spaltung einer einzelnen Peptidbindung im Proenzym aktiviert und werden so katalytisch aktiv. Eine weitere Kontrolle über den Spezifitätsgrad für ein Zielmolekül oder Zielmoleküle wird durch den dem Enzym inhärenten Spezifitätsgrad bestimmt. Eine weitere Kontrolle über Zeitpunkt und Ort der Wirkung erfolgt häufig durch Proteininhibitoren der erforderlichen Spezifität.
Die Struktur von Trypsinogen ist im Allgemeinen viel näher an der von Trypsin als Chymotrypsinogen an Chymotrypsin, Die Struktur von Trypsinogen schließt die Möglichkeit der Substratbindung in einem Modus ähnlich dem für Trypsin nicht aus, obwohl Änderungen in der Struktur dieser Region zu einem beeinträchtigten oder veränderten Substratbindungsmodus beitragen – sicherlich für Benzamidin und höchstwahrscheinlich für eine Substratseitenkette, Wenn das Proenzym als starr angesehen wird, dann der allgemeine Basiskatalysator und die Oxyanion-Bindungsstelle, die durch die N-Gruppe gebildet wird H-Gruppen von Gly193 und Ser195 sind zu weit voneinander entfernt zusammenarbeit bei der Substrathydrolyse. Selbst wenn sich die Proenzymstruktur bei der Substratbindung ändern würde, wie es wahrscheinlich erscheint, kann die unproduktive Bindung eine weitere wichtige Komponente für die Zymogeninaktivität darstellen. Eine solche Bindung könnte immer noch einen zu großen Abstand oder eine ungünstige Wechselwirkung zwischen dem Substrat und Elementen des katalytischen Zentrums hinterlassen. Die veränderte Position der Kette zwischen Lys188A und Ser195 und der Hauptkette zwischen Trp215 und Ser217 könnte für eine kompetitive, aber nicht produktive Substratbindung verantwortlich sein, ebenso wie die N-H-Gruppe von Gly193, da sie normalerweise an der Ausrichtung des Substrats beteiligt sind. Diese Möglichkeiten rematin als Hauptkandidaten in einem universellen Schema für die Inaktivität der Trypsinogen-ähnlichen Zymogene.
Die Bauchspeicheldrüse sezerniert Zymogene teilweise, um zu verhindern, dass die Enzyme Proteine in den Zellen verdauen, in denen sie synthetisiert werden. Enzyme wie Pepsin entstehen in Form von Pepsinogen, einem inaktiven Zymogen. Pepsinogen wird aktiviert, wenn die Zellen es in die Magensäure abgeben, deren Salzsäure es teilweise aktiviert. Ein weiteres teilweise aktiviertes Pepsinogen vervollständigt die Aktivierung, indem es das Peptid entfernt und das Pepsinogen in Pepsin umwandelt. Eine versehentliche Aktivierung von Zymogenen kann auftreten, wenn der Sekretionskanal in der Bauchspeicheldrüse durch einen Gallenstein blockiert wird, was zu einer akuten Pankreatitis führt.
Pilze scheiden auch Verdauungsenzyme als Zymogene in die Umwelt aus. Die äußere Umgebung hat einen anderen pH-Wert als innerhalb der Pilzzelle und dies verändert die Struktur des Zymogens in ein aktives Enzym.Eine andere Möglichkeit, wie Enzyme in inaktiven Formen existieren und später in aktive Formen umgewandelt werden können, besteht darin, nur dann zu aktivieren, wenn ein Cofaktor, ein sogenanntes Coenzym, gebunden wird. In diesem System wird die inaktive Form (das Apoenzym) zur aktiven Form (das Holoenzym), wenn das Coenzym bindet.