zymogenは、プロ酵素とも呼ばれ、触媒活性を示さないが、生物内で酵素に変換されるタンパク質のグループのいずれか、特に酵素の分解を含む反応を触媒するものである。タンパク質だ 生化学的変化は、通常、前駆体酵素の特定の部分がそれを活性化するために切断されるゴルジ体で起こる。 切断される不活性化片は、ペプチド単位であり得るか、または1 0 0残基を超える残基を含む独立して折り畳みドメインであり得る。 それらは酵素の能力を制限するが、酵素のこれらのn末端伸長または「伸長」は、しばしば、それらが阻害する酵素の安定化および折り畳みを援助する。
タンパク質分解酵素は、他のタンパク質の作用を調節または制御する上で重要な役割を果たすことがよく認識されています。
タンパク質分解酵素は、他のタンパク質の作用を調節または制御する上で重要な役割を果たす。 このような酵素は、細菌からヒトまでのすべての種およびホルモン産生、バクテリオファージの組み立て、発達、受精、消化、侵入生物に対する防御、および組織修復を含む多様な系の制御において見出すことができる。 ほとんどの場合、タンパク質分解酵素は、不活性前駆体プロ酵素、またはジモゲンとして合成されることが知られている。 それらはproenzymeの単一のペプチッド結束の蛋白質分解開裂によって活動化させ、従って触媒的に活動的になります。 標的分子または分子に対する特異性の程度に対するさらなる制御は、酵素に固有の特異性の程度によって決定される。 作用の時間および位置のさらなる制御は、しばしば必要な特異性のタンパク質阻害剤によって行われる。
トリプシノーゲンの構造は、一般的にキモトリプシンにキモトリプシンであるよりもトリプシンのそれにはるかに近いです,トリプシノーゲンの構造は、トリプシンのために見つかったのと同様のモードでの基質結合の可能性を排除するものではありません,この領域の構造の変化は、障害または変更された基質結合モードに貢献しているが、-確かにベンザミジンのために、最もおそらく基質側鎖のために,プロ酵素が剛性であると考えられている場合,その後、一般的な塩基触媒とnによって形成されるオキシアニオン結合部位-gly193およびser195のhのグループは余りに遠く離れています 基質の加水分解で協力するため。 プロ酵素構造が基質結合上で変化したとしても、可能性が高いと思われるように、非生産的結合は、zymogenの非活性のための別の重要な成分を提供するかも そのような結合は、基質と触媒中心の要素との間にあまりにも大きな距離、または好ましくない相互作用を残す可能性がある。 Lys188AとSer195との間の鎖の変更された位置とTrp215とSer217との間の主鎖は、彼らが通常、基板の配向に関与しているので、Gly193のN-H基ができたように、競合 これらの可能性は、トリプシノーゲン様ジモゲンの非活性のための普遍的なスキームにおける主要な候補として再結合する。
膵臓は、酵素が合成された細胞内のタンパク質を消化するのを防ぐために、部分的にジモゲンを分泌する。 ペプシンのような酵素はpepsinogen、不活性zymogenの形で作成されます。 ペプシノーゲンは、主細胞がそれを胃酸に放出し、その塩酸が部分的に活性化すると活性化される。 別の部分的に活性化されたペプシノーゲンは、ペプチドを除去してペプシノーゲンをペプシンに変えることによって活性化を完了する。 膵臓の分泌管が急性膵炎を生じる胆石によってブロックされたときに、ジモゲンの偶発的な活性化が起こり得る。
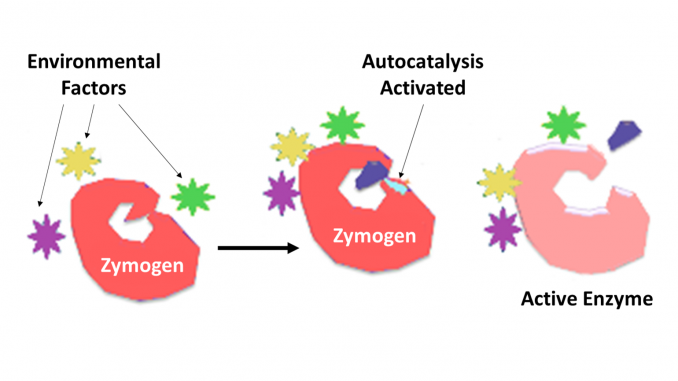
真菌はまた、zymogensとして環境に消化酵素を分泌します。 外部環境は真菌細胞の内部とは異なるpHを有し、これはジモジェンの構造を活性酵素に変化させる。酵素が不活性形態で存在し、後に活性形態に変換される別の方法は、補酵素と呼ばれる補因子が結合している場合にのみ活性化することである。
酵素が不活性形態で存在し、後に活性形態に変換されることができる。 このシステムでは、補酵素が結合すると、不活性型(アポ酵素)が活性型(ホロ酵素)になる。