systemowy przegląd roli okulisty w diagnostyce choroby Wilsona
Emily S. Birkholz, MD, Thomas A. Oetting, MS, MD
lipiec 28, 2009
Główna Skarga: skierowanie do oceny pierścieni Kayser-Fleischer
Historia obecnej choroby: Pacjentem był 25-letni mężczyzna, który przez ostatnie kilka miesięcy odczuwał prawostronną tkliwość podżebrową i narastające zmęczenie. Zauważył również ciemny mocz, żółtaczkę i utratę wagi 60 funtów. Pacjent został przyjęty na badania i leczenie swojego niezdiagnozowanego stanu. Jego zespół szpitalny był zaniepokojony możliwą chorobą Wilsona i skierował pacjenta do kliniki okulistycznej w celu oceny pierścieni Kaysera-Fleischera. Nie miał zmian w widzeniu ani innych dolegliwości ocznych.
warto zauważyć, że biopsja wątroby w wieku 14 lat, wykonana po tym, jak stwierdzono, że ma nieprawidłowe wyniki rutynowych badań przed wycięciem migdałków, wykazała stłuszczenie wątroby, które uważano za związane z jego wagą. Nie miał żadnych dodatkowych obserwacji.
Wywiad oczny w przeszłości: brak
wywiad medyczny: w wieku 14 lat pacjent przeszedł biopsję wątroby z rozpoznaniem stłuszczenia wątroby. W wieku 14 lat poddano go również zabiegowi tonsillektomii.
leki: brak
historia rodzinna: nie ma historii rodzinnej choroby wątroby. Matka pacjenta była alkoholiczką.
Historia społeczna: Pacjent jest obecnie uwięziony za włamanie. Donosi o intensywnym spożyciu alkoholu (więcej niż jedno sześciopak piwa dziennie przez ponad osiem lat). Pali jedną paczkę papierosów dziennie i zgłasza wcześniejsze zażywanie marihuany, LSD i kokainy w przeszłości.
Przegląd systemów: pacjent zgłosił niezamierzoną utratę wagi 60 funtów. Nie miał zmian nastroju, zmian behawioralnych ani zaburzeń ruchowych.
badanie okulistyczne:
- najlepiej skorygowana ostrość widzenia: 20/20 OD i 20/20 OS.
- źrenice: 6 mm W ciemności, 3 mm w świetle, bez RAPD OU
- IOP: 12 mmHg OD I 14 mmHg OS
- EOM: pełny OU
- CVF: pełny ou
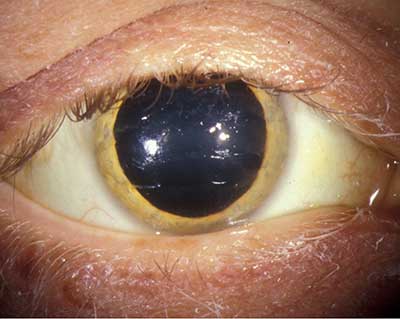
- odcinek przedni patrz rysunek 1. Scleral icterus OU, pasmo 1-2 mm złocistobrązowe widziane u limbus OU.
- DFE: normalne dyski, normalne plamki, obrzeża i naczynia OU.
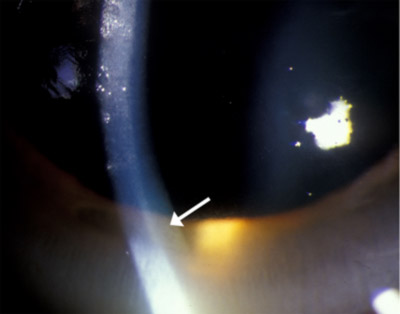
| rysunek 1a: złoty brązowy pierścień Kayser-Fleischer | rysunek 1b: Większe powiększenie zdjęcie Złotego Pierścienia na poziomie membrany Descemeta |
|
|
| Rysunek 1C: Gonioskopia kąta, pokazująca złocisty depozyt w membranie Descemeta | |
 |
|
przebieg
przyjęty do uihc na badania diagnostyczne, a także leczenie ciężkiej niewydolności wątroby. Późniejsze badania wykazały pogorszenie wyników testów czynnościowych wątroby. Miał normalne stężenie ceruloplazminy w surowicy i miedzi w surowicy, ale miał podwyższony poziom miedzi w moczu 189 ng / ml (normalne jest 12-80) i zwiększone wydalanie miedzi w moczu 1522 mcg/dzień (normalne jest 3-35) po teście wydalania penicylaminy. Jego biopsja wątroby wykazała wątrobową miedź kwantyfikację 763 mcg miedzi na gram suchej masy (normalne jest 10-35 mcg / gm).
ze względu na obecność pierścieni Kaysera-Fleischera, zwiększone wydalanie miedzi w moczu po badaniu wydalania penicylaminy oraz diagnostyczną biopsję wątroby u pacjenta zdiagnozowano chorobę Wilsona. Następnie był leczony penicylaminą 250 mg 4 razy na dobę i pirydoksyną 25 mg PO na dobę, co poprawiło klirens miedzi w moczu. Jednak rozwinął znaczącą encefalopatię, stopniowo pogarszającą się koagulopatię z hemolizą i niedokrwistością choroby wątroby oraz znaczące wodobrzusze. Jego choroba wątroby postępowała w ciągu jego dwutygodniowego leczenia szpitalnego, a on wykazywał przebieg podprzestrzenny. Jego hepatolodzy uważali, że choroba prawdopodobnie doprowadzi do niewydolności wątroby i prawdopodobnej śmierci. Przeszczep wątroby nie był możliwy w UIHC ze względu na jego historię spożywania alkoholu i słabą sieć wsparcia. Następnie został przeniesiony do szpitala bliżej rodziny.
dyskusja: choroba Wilsona
choroba Wilsona, opisana po raz pierwszy w 1912 roku przez Kinneara Wilsona, jest rzadką, autosomalną recesywną chorobą polegającą na zmniejszonym wydalaniu miedzi z żółcią i odkładaniu miedzi w organizmie, przede wszystkim w wątrobie, mózgu, nerkach i rogówce. Choroba jest spowodowana mutacją genetyczną w genie ATP7B na chromosomie 13, który koduje związaną z błoną Miedziową Atpazę transportującą znajdującą się głównie w wątrobie (Tanzi, 1993). U pacjentów z chorobą Wilsona może występować przewlekła choroba wątroby, piorunująca niewydolność wątroby, ostra niewydolność nerek, niedokrwistość hemolityczna lub choroba neuropsychiatryczna, taka jak zaburzenia ruchowe, drżenia, brak koordynacji i zmiany zachowania (patrz Tabela 1). Choroba może występować w każdym wieku, ale zwykle występuje między 1. A 4. dekadą życia (Schoen, 1990). Częstość występowania na świecie wynosi 1 na 30 000 (Scheinberg, 1984). Nieleczona choroba jest śmiertelna. Typowe zabiegi z penicylaminą, trientyną i / lub terapią cynkową (zabiegi chelatacji miedzi), a także dieta o niskiej zawartości miedzi są przedsięwzięciami trwającymi całe życie, a transplantacja wątroby ratuje życie w bardzo zaawansowanych przypadkach (Mak, 2008).
| wątroba | neurologiczne | psychiatryczne |
|---|---|---|
|
żółtaczka ostre zapalenie wątroby marskość wątroby przewlekła choroba wątroby piorunująca niewydolność wątroby ostre niewydolność nerek niedokrwistość hemolityczna |
drżenie dystonia bradykinezja brak koordynacji bezsenność spastyczność pląsawica ślinotok drgawki migrena |
schizofrenia Depresja maniakalne zaburzenie depresyjne urojenia zaburzenia behawioralne zmiany osobowości |
diagnozowanie choroby Wilsona
choroba Wilsona jest zwykle podejrzewana u młodych pacjentów w wieku poniżej czterdziestu lat, którzy mają niewyjaśnioną chorobę wątroby, niewyjaśnioną neurologiczną chorobę behawioralną i/lub chorobę psychiczną.ustawienie choroby wątroby, lub historii rodzinnej choroby Wilsona. Rozpoznanie choroby Wilsona często opiera się na kryteriach Sternlieba, gdzie pacjent musi mieć co najmniej dwa z następujących stwierdzeń: obecność pierścieni Kaysera-Fleischera, typowe objawy neurologiczne i/lub niski poziom ceruloplazminy (<0,20 g / L) (Sternlieb, 1990). Niestety, kryteria te są często spełnione tylko wtedy, gdy pacjent prezentuje zaawansowaną chorobę i zwykle mają objawy neurologiczne i/lub psychiatryczne. Pacjenci z wczesną chorobą, chorobą wątroby lub chorobą bezobjawową są bardzo trudni do zdiagnozowania.
nie istnieje żaden test laboratoryjny, który wiarygodnie identyfikuje chorobę Wilsona, ale kombinacja testów, w tym Ceruloplazmina w surowicy, wolna miedź w surowicy i 24-godzinne wydalanie miedzi z moczem, są używane razem do identyfikacji nieprawidłowości w metabolizmie miedzi.
Ceruloplazmina jest białkiem wytwarzanym przez hepatocyty, które wiąże miedź i dostarcza ją do tkanek obwodowych. Gdy miedź jest niedostępna, z powodu niedoboru transportu przezbłonowego, do włączenia do cząsteczki apoceruloplazminy, tak jak w chorobie Wilsona, uwolniona apoceruloplazmina jest szybko metabolizowana, powodując niski poziom ceruloplazminy w krążeniu. Normalny poziom ceruloplazminy we krwi wynosi 0,20 do 0,40 g / L, jednak wartość ta nie ma zastosowania do pacjentów pediatrycznych, ciężarnych lub pacjentów przyjmujących estrogen. Inne choroby mogą powodować niskie poziomy, w tym niedożywienie, zespół nerczycowy, dziedziczna aceruloplazminemia lub zaburzenia zapalne (ponieważ jest to reakcja ostrej fazy). Ponadto, poziom ceruloplazminy może być prawidłowy u pacjentów z chorobą Wilsona, cytowany jako od 35% do 45% u pacjentów z wątrobą i 60% u pacjentów z piorunującą niewydolnością wątroby (Steindl, 1997). Dlatego u pacjentów z chorobami wątroby normalny poziom ceruloplazminy nie może wykluczyć choroby Wilsona, ani niski poziom nie jest wystarczający do postawienia diagnozy choroby Wilsona.
- pierścienie Kaysera-Fleischera
- niski poziom ceruloplazminy w surowicy (<0,20 g/l, normalny wynosi 0,20 do 0,40 g/l)
- 24-godzinne wydalanie miedzi w moczu (>100 µg/dobę lub 1.0 mol/dzień)
- 24-godzinne wydalanie miedzi z moczem po D-penacylaminie (>25 mol/dzień)
- zawartość miedzi w wątrobie w biopsji wątroby (>250 µg/g suchej masy, normalna wynosi< 50 µg/g suchej masy ciała)
- mutacja genetyczna genu atp7b
24-godzinne wydalanie miedzi z moczem jest zawsze zwiększone u pacjentów z chorobą Wilsona (>100 µg/dobę lub 1.0 mol/dzień), ale dokładne wyniki są trudne do uzyskania, ponieważ zgodność może być niska, może wystąpić niekompletne zbieranie i zanieczyszczenie z egzogennej miedzi może wystąpić, gdy pojemnik do zbierania moczu jest płukany wodą z kranu. Mierzenie 24-godzinnego wydalania miedzi z moczem przed i po podaniu d-penacylaminy może pomóc w rozróżnieniu pacjentów z Wilsonem od pacjentów z innymi zaburzeniami czynności wątroby, ponieważ u pacjentów z Wilsonem wydalanie będzie przekraczało 25 mol / dobę. Wykazano, że test ten ma czułość 76-88%% i swoistość 93-98% (Martins da Costa, 1992 i Muller, 2007). Test ten nie był jednak wiarygodny w diagnozowaniu bezobjawowych pacjentów z chorobą Wilsona (czułość 46%) i jest dość uciążliwy dla pacjentów do wykonania (Muller, 2007).
Ostatnio donoszono o zastosowaniu stosunku fosfatazy alkalicznej do bilirubiny całkowitej i (lub) stosunku AspAT do alat, aby pomóc w rozpoznaniu choroby Wilsona w ostrej niewydolności wątroby. Publikacja Korman i in. donosi, że stosunek fosfatazy alkalicznej do bilirubiny całkowitej mniejszy niż 4 dawał 94% czułości i 96% swoistości z prawdopodobieństwem 23 w diagnozowaniu piorunującej choroby Wilsona. Raportują również, że stosunek AspAT:alat większy niż 2,2 był 94% wrażliwy i 86% specyficzny z prawdopodobieństwem 7 dla diagnozowania piorunującej choroby Wilsona, a po połączeniu testów czułość diagnostyczna i swoistość wynosiły 100% (Korman, 2008).
złotym standardem w diagnostyce choroby Wilsona jest pomiar zawartości miedzi w wątrobie w biopsji wątroby. Według Ferenci et al. zawartość miedzi >250 µg/g suchej masy (normalna, do 50 µg/g suchej masy) jest 83% wrażliwa i 98,6% specyficzna dla diagnozowania choroby Wilsona, ale wykonywanie biopsji wątroby jest zabiegiem inwazyjnym i ryzykownym u pacjentów z ciężką niewydolnością wątroby z koagulopatią (Ferenci, 2005).
badania genetyczne genu ATP7B można przeprowadzić z dużą czułością, jeśli mutacja jest znana z probandu lub jeśli pacjent ma jedną z powszechnych mutacji genetycznych w chorobie Wilsona. Jednak badania genetyczne nie są rutynowo stosowane jako narzędzie diagnostyczne, ponieważ testy są uciążliwe ze względu na długą długość genu (21 eksonów), jego liczne mutacje (ponad 70 różnych mutacji) oraz fakt, że większość pacjentów ma dwie różne mutacje (heterozygote złożone) (Mak, 2008).
ze względu na trudności w diagnozowaniu choroby Wilsona, 8. międzynarodowe spotkanie poświęcone chorobie Wilsona stworzyło system punktacji, który opiera się na siedmiu kryteriach, w tym na obecności pierścieni Kaysera-Flesichera; typowe objawy neurologiczne; zmniejszone stężenie ceruloplazminy w surowicy; ujemna niedokrwistość hemolityczna Coombsa; zwiększone wydalanie miedzi z moczem; wysoka wartość miedzi w wątrobie przy braku cholestazy; i wyniki mutacji. Podobnie jak wszystkie inne badania laboratoryjne, ten system punktacji wydaje się być bardziej wiarygodny u pacjentów z zaawansowaną chorobą (Ferenci, 2003).
Pierścień Kaysera-Fleischera
pierścień Kaysera-Fleischera jest znakiem rozpoznawczym choroby Wilsona i jej wykrycie może mieć kluczowe znaczenie dla rozpoznania. Istnieją doniesienia, że była to pierwsza wykrywalna manifestacja choroby Wilsona, która doprowadziła do wczesnego rozpoznania i leczenia choroby (Liu, 2002).
obecność pierścieni Kaysera-Fleischera w połączeniu z małą ceruloplazminą w surowicy jest uważana za diagnostykę choroby Wilsona w oparciu o kryteria Sternlieba (Martins da Costa, 1992). W rogówce nadmiar krążącej miedzi osadza się w błonie Descemeta i jest zwykle postrzegany jako złocisty brązowy pierścień znajdujący się w rogówce obwodowej, rozpoczynający się na linii Schwalbe ’ a i rozciągający się mniej niż 5 mm na rogówkę (patrz wideo). Pierścień może również wyglądać jak zielonkawy żółty, rubinowy czerwony, jasnozielony lub ultramarynowy niebieski. Jest ona prawie zawsze obustronna i najpierw pojawia się nadrzędnie, potem podrzędnie, a potem staje się obwodowa (Kim, 1979). We wcześniejszych stadiach choroby gonioskopia jest często potrzebna do wykrycia tego subtelnego odkrycia, ale w zaawansowanej chorobie można ją zobaczyć gołym okiem.
Video 1: Golden Brown Kayser Fleischer ring
alternatywny link do Golden Brown Kayser Fleischer ring
pierścienie te zaobserwowano u około 85% -100% pacjentów z neurologicznymi i (lub) psychiatrycznymi objawami choroby Wilsona, ale tylko 33% -86% pacjentów z chorobami wątroby i 0% -59% pacjentów bezobjawowych (Mak, 2008). Pierścienie Kaysera-Fleischera mogą być nieobecne u nawet 50% pacjentów z wilsońską chorobą wątroby oraz w jeszcze większym odsetku z piorunującą wilsońską chorobą wątroby (Steindl, 1997). Istnieje wiele warunków, które również były związane z kolorowymi pierścieniami w rogówce, w tym inne choroby wątroby, takie jak pierwotna marskość żółciowa, noworodkowe zapalenie wątroby i kryptogenna marskość wątroby lub podwyższona miedź z innych powodów, takich jak szpiczak mnogi, rak płuc, łagodne gammopatie monoklonalne, przewlekła białaczka limfocytowa, a nawet doustne stosowanie antykoncepcyjne. Po rozpoczęciu leczenia pierścień Kaysera-Fleischera znika w 85-90% przypadków (Lossner, 1986).
choroba Wilsona w UIHC
na University of Iowa Klinika Okulistyczna i szpitalna często otrzymują konsultacje w celu oceny pierścieni Kaysera-Fleischera u pacjentów z niewyjaśnioną chorobą wątroby, ale niewielu okulistów kiedykolwiek widziało prawdziwy pierścień Kaysera Fleischera. W badaniu przeprowadzonym wśród wszystkich uczestników, stypendystów i rezydentów UIHC tylko 11 lekarzy zgłosiło, że kiedykolwiek widziało pierścień Kaysera-Fleischera (41%), a łącznie odnotowano 24 przypadki w ciągu całej kariery wszystkich badanych okulistów. Często pierścienie Kaysera-Fleischera u jednego pacjenta były obserwowane przez wielu okulistów na oddziale, więc całkowita liczba zdiagnozowanych pacjentów jest mniejsza niż całkowita liczba odnotowanych przypadków. Spośród tych, którzy widzieli pierścień Kaysera-Fleischera, tylko sześciu okulistów widziało więcej niż jeden przypadek. Dla 64% lekarzy identyfikacja pierścienia Kaysera-Fleischera była pomocna w rozpoznaniu choroby Wilsona w co najmniej jednym przypadku.
badanie sześciu hepatologów na Uniwersytecie Iowa, trzeciorzędowym ośrodku opieki, ujawniło tylko cztery nowe diagnozy choroby Wilsona w średnim okresie praktyki klinicznej 13 lat na lekarza. Według sondażu żaden ze zgłoszonych przypadków nie miał pierścienia Kaysera-Fleischera.
badano również neurologię dotyczącą ich doświadczenia w diagnozowaniu choroby Wilsona. Jeden neurolog, który praktykował przez 37 lat, widział tylko jednego pacjenta z chorobą Wilsona, a pacjent miał pierścień Kaysera-Fleischera. Jeden inny neurolog, który brał udział w badaniu, praktykował przez siedem lat i nie widział żadnych pacjentów z chorobą Wilsona.
koszt diagnozowania choroby Wilsona w UIHC:
mając na uwadze stale rosnące koszty opieki zdrowotnej, przeprowadzono badanie średniego kosztu diagnozowania pacjenta z chorobą Wilsona w UIHC. W większości przypadków do postawienia diagnozy wymagane są konsultacje specjalistyczne oraz badania laboratoryjne. W przypadku samej podstawowej oceny laboratoryjnej koszt wynosi 190 USD (AspAT, alat, fosfataza alkaliczna, bilirubina całkowita i Ceruloplazmina w surowicy), nie wliczając innych testów laboratoryjnych, które normalnie byłyby rysowane u pacjenta z jakąkolwiek chorobą wątroby, w tym hemoglobiną, płytkami krwi, podstawowym panelem metabolicznym i poziomem albumin (patrz tabela 3a). W przypadkach trudności diagnostycznych (wczesna prezentacja lub choroba wątroby tylko), diagnoza może kosztować do $605 do oceny laboratoryjnej (w tym testy czynnościowe wątroby, ceruloplazminy, i 24-godzinne wydalanie miedzi w moczu), oprócz ambulatoryjnych opłat konsultacyjnych dla okulistyki ($300), Hepatologii ($935), i/lub neurologii ($775), za całkowity koszt $2,615 (patrz tabele 3a, 3B, i 3c). Całkowity koszt wykonania złotej standardowej biopsji wątroby wynosi 3105 USD, która obejmuje opłatę za lekarza, opłatę za szpital, opłatę za patologię, a także wysyłanie wartości laboratoryjnej dla zawartości miedzi w wątrobie. W sumie, gdyby wszystkie badania laboratoryjne, Usługi konsultacyjne i biopsja wątroby zostały wykorzystane, całkowity koszt byłby $5,720 (patrz tabela 3C
| Lab Test | Cost |
|---|---|
| AST | $29 |
| ALT | $34 |
| ALP | $32 |
| Total Bilirubin | $29 |
| Serum Ceruloplasmin | $66 |
| 24-h urine copper excretion | $70 |
| Hepatic Copper Content (from liver biopsy send out lab) |
$275 |
| Consult/Procedure | Cost |
|---|---|
| Ophthalmology outpatient consult (low-moderate complexity) | $300 |
| Ophthalmology inpatient consult (low-moderate complexity) | $280 |
| Neurology Outpatient consult (moderate-high complexity) | $775 |
| Neurology Inpatient Consultation (moderate-high complexity) | $650 |
| Hepatology Outpatient Consultation (moderate-high complexity) | $935 |
| Hepatology Inpatient Consultation (moderate-high complexity) | $860 |
| Liver Biopsy: Total (outpatient costs) | $2,830 |
| Physician charge | $1,226 |
| Hospital charge | $926 |
| Pathology professional fee | $312 |
| Pathology technical fee | $366 |
| services | cost |
|---|---|
|
Diagnosis without ophthalmology consultation |
$2,315 |
|
Diagnosis with ophthalmology consultation |
$2,615 |
|
Total cost of liver biopsy |
$3,105 |
|
Diagnosis with all common tests, consults, and biopsja wątroby |
$5,720 |
podsumowanie
chociaż bardzo rzadko w UIHC z zaledwie czterema do pięciu nowymi diagnozami choroby Wilsona w średnim okresie 13 lat na podstawie badanie hepatologów, ocena Okulistyczna w poszukiwaniu pierścieni Kayser-Fleischer jest nadal bardzo istotnym narzędziem diagnostycznym i jest nieinwazyjnym, niedrogim sposobem pomocy w diagnostyce potencjalnie śmiertelnej choroby. Jednak niewielu okulistów ma doświadczenie w identyfikacji pierścienia Kaysera-Fleischera, ponieważ tylko 41% okulistów ankietowanych na University of Iowa kiedykolwiek go widziało.
Kiedy pacjent ma zaawansowaną chorobę lub neurologiczne i/lub psychiatryczne objawy choroby Wilsona, pierścień Kaysera-Fleischera jest obecny w prawie wszystkich przypadkach i może nieinwazyjnie pomóc w ugruntowaniu diagnozy. Gdy pacjent ma mniej zaawansowaną chorobę lub tylko chorobę wątroby, diagnoza jest znacznie trudniejsza i często konieczna jest krytyczna ocena wszystkich dostępnych badań, aby potwierdzić diagnozę. Ponieważ wiele badań laboratoryjnych jest niejednoznacznych u pacjentów z mniej zaawansowaną chorobą, a biopsja wątroby ze złotym standardem jest zabiegiem inwazyjnym i kosztowym, nieinwazyjna ocena pierścienia Kaysera-Fleischera jest nadal istotną częścią prac diagnostycznych w chorobie Wilsona. W tych przypadkach identyfikacja pierścienia Kaysera-Fleischera jest często znacznie trudniejsza, ponieważ pierścień może być bardzo słaby i identyfikowalny tylko w gonioskopii. Dlatego ocena w klinice z wykorzystaniem lampy szczelinowej i soczewki gonioskopowej jest niezbędna w tej grupie pacjentów.
- Aldave AJ, King JA, Kim BT, Hopp L. osadzanie miedzi rogowej związane z przewlekłą białaczką limfocytową. Am J Ophthalmol 2006;142: 174-6.
- Ferenci P, Caca K, Loudianos G, Mieli-Vergani G, Tanner S, Sternlieb I, Schilsky M, Cox D, Berr F. diagnoza i klasyfikacja fenotypowa choroby Wilsona. Liver Int 2003; 23: 139 – 142.
- Ferenci P, Steindl-Munda P, VogelW, JessnerW, Gschwantler m, Stauber R, Datz C, Hackl F, Wrba F, Bauer P, Lorenz O. wartość diagnostyczna ilościowego oznaczania miedzi wątrobowej u chorych z chorobą Wilsona. Clin Gastroenterol Hepatol 2005; 3: 811-818.
- Fleming CR, Dickson ER, Wahner HW, Hollenhorst RW, McCall JT. Pigmentowane pierścienie rogówki w nie-Wilsońskiej chorobie wątroby. Ann Intern Med 1977;86:285-8.
- Frommer D, Morris J, Sherlock S, Abrams J, Newman S. Kayser-Fleischer-podobne pierścienie u pacjentów bez choroby Wilsona. Gastroenterology 1977; 72:1331-5.
- Garmizo G, Frauens BJ. Odkładanie się miedzi w rogówce wtórne do doustnych środków antykoncepcyjnych. Optom Vis Sci. 2008 Sep; 85 (9): E802-7.
- Hawkins AS, Stein RM, Gaines BI, Deutsch TA. Odkładanie się miedzi w oku związane ze szpiczakiem mnogim. Am J Ophthalmol 2001;131: 257-9.
- Kim HB, Kim JC, Byan YJ. Kayser Fleischer ring w chorobie Wilsona. J Korean Ophthal Soc 1979;20:129-31.
- Korman JD, Volenber I, Balko J, et al. Screening for Wilson disease in acute liver failure: a comparison of currently available diagnostic tests. Hepatologia. 2008;48(4): 1167-74.
- Liu m, Cohen EJ, Brewer GJ, Laibson PR. Pierścień Kaysera-Fleischera jako objaw choroby Wilsona. Am J Ophthalmol. 2002 Jun; 133(6): 832-4.
- Lossner a, Lossner J, Bachmann H, Zotter J. pierścień Kaysera Fleischera podczas długotrwałego leczenia choroby Wilsona (zwyrodnienie hepatolenticular): badanie uzupełniające. Graefes Arch Clin Exp Ophthalmol. 1986;224:152-5.
- Mak CM, Lam CW. Diagnoza choroby Wilsona: kompleksowy przegląd. Krytyczne recenzje w klinicznych naukach laboratoryjnych. 2008;45(3):263-290.
- Martin NF, Kincaid MC, Stark WJ, Petty BG, Surer JL, Hirst LW, Green WR. Odkładanie się miedzi ocznej związane z rakiem płucnym, gammopatią Monoklonalną IgG i hiperkupremią. Korelacja kliniczno-patologiczna. Okulistyka 1983; 90:110-16.
- Martins da Costa C, Baldwin D, Portmann B, Lolin Y, Mowat AP, Mieli-Vergani G. wartość wydalania miedzi z moczem po prowokacji penicylaminy w diagnostyce choroby Wilsona. Hepatologia 1992; 15: 609-615.
- Muller T, Koppikar S, Taylor RM, Carragher F, Schlenck B, Heinz-Erian P, Kronenberg F, Ferenci P, Tanner S, Siebert U, Staudinger R, Mieli-Vergani G, Dhawan A. Re-evaluation of the penicilamine challenge test in the diagnosis of Wilson ’ s disease in children. J Hepatol 2007; 47: 270-276.
- Probst LE, Hoffman e, Cherian MG, Yang J, Feagan B, Adams P, Nichols B. osadzanie miedzi ocznej związane z łagodną gammopatią monoklonalną i hiperkupremią. Cornea 1996;15: 94-8.
- Scheinberg i, Sternlieb I. choroba Wilsona. Major Problemik Med 1984; 23: 1 – 24.
- Schoen RE, Sternlieb I. kliniczne aspekty choroby Wilsona. Am J Gastroenterol-1990; 85: 1453-7.
- Steindl P, Ferenci P, Dienes HP. Choroba Wilsona u pacjentów z chorobami wątroby: wyzwanie diagnostyczne. Gastroenterology 1997; 113: 212-218.
- Sternlieb I. perspektywy choroby Wilsona. Hepatologia 1990; 12: 1234 – 1239.
- Tanzi RE, Petrukhin K, Chernov I, et al. Gen choroby Wilsona jest miedzią transportującą Atpazę o homologii do genu choroby Menkesa. Nat Genet 1993; 5: 344-50.
Specjalne podziękowania dla dr. Michaela Voigta, Dr. Bruce Luxon, dr Stephanie Dee, Dr Kyle Brown, dr Douglas LaBrecque i dr Warren Schmidt, wszyscy wchodzą w skład oddziału Hepatologii Wydziału Gastroenterologii Uniwersytetu Iowa Hospitals and Clinics (UIHC). Dzięki również dr Robert Rodnitzky i dr Pedro Gonzalez w Klinice Neurologii UIHC.
sugerowany Format cytowania: Birkholz ES, Oetting TA. Kayser Fleischer Ring: a Systems Based Review of the Ophthalmologist 's Role in the Diagnosis of Wilson’ s Disease. EyeRounds.org. 28 lipca 2009; dostępne od: http://www.EyeRounds.org/cases/97-kayser-fleischer-ring-Wilsons-Disease.htm.