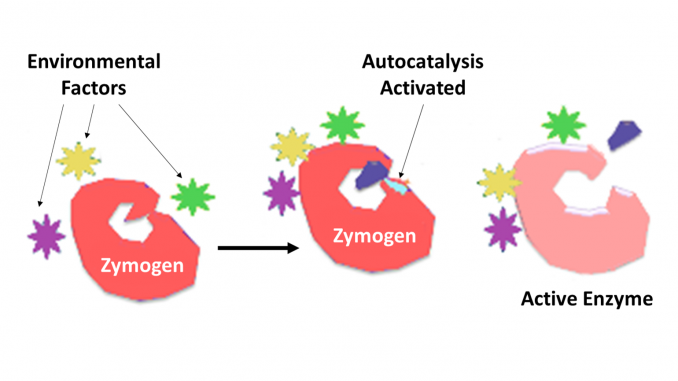
Zymogen, de asemenea, numit proenzima, orice dintr-un grup de proteine care nu prezintă activitate catalitică, dar sunt transformate în interiorul unui organism în enzime, în special cele care catalizează reacțiile care implică descompunerea proteinelor. Schimbarea biochimică apare de obicei în corpurile Golgi, unde o parte specifică a enzimei precursoare este scindată pentru a o activa. Piesa de inactivare care este scindată poate fi o unitate peptidică sau poate fi domenii de pliere independente care conțin mai mult de 100 de reziduuri. Deși limitează capacitatea enzimei, aceste extensii n-terminale ale enzimei sau un „prosegment” ajută adesea la stabilizarea și plierea enzimei pe care o inhibă.
acum este bine recunoscut faptul că enzimele proteolitice joacă roluri cheie în reglarea sau controlul asupra acțiunii altor proteine. Astfel de enzime pot fi găsite în toate speciile de la bacterii la om și în controlul diverselor sisteme, care includ producția de hormoni, asamblarea bacteriofagului, dezvoltarea, fertilizarea, digestia, apărarea împotriva organismelor invadatoare și repararea țesuturilor. În cele mai multe cazuri, enzimele proteolitice sunt cunoscute a fi sintetizate ca proenzime precursoare inactive sau chimogeni. Acestea sunt activate prin scindarea proteolitică a unei singure legături peptidice în proenzimă și astfel devin active catalitic. Controlul suplimentar asupra gradului de specificitate pentru o moleculă sau molecule țintă este determinat de gradul de specificitate inerent enzimei. Controlul suplimentar asupra timpului și localizării acțiunii este adesea efectuat de inhibitorii proteici ai specificității necesare.
structura tripsinogenului este în general mult mai apropiată de cea a tripsinei decât este chimotripsinogenul de chimotripsină, structura tripsinogenului nu exclude posibilitatea legării substratului într-un mod similar cu cel găsit pentru tripsină, deși modificările structurii acestei regiuni contribuie la un mod de legare a substratului afectat sau modificat-cu siguranță pentru benzamidină și cel mai probabil pentru un lanț lateral de substrat, dacă proenzima este considerată rigidă, atunci catalizatorul general de bază și situsul de legare a oxianionului format de N-H grupurile de gly193 și ser195 sunt prea îndepărtate să coopereze în hidroliza substratului. Chiar dacă structura proenzimei s-ar schimba la legarea substratului, așa cum pare probabil, legarea neproductivă poate oferi o altă componentă importantă pentru inactivitatea zymogenului. O astfel de legare ar putea lăsa în continuare o distanță prea mare sau o interacțiune nefavorabilă între substrat și elementele Centrului catalitic. Poziția modificată a lanțului dintre Lys188A și Ser195 și lanțul principal dintre Trp215 și Ser217 ar putea fi responsabilă pentru legarea substratului competitivă, dar neproductivă, la fel ca și grupul N-H al Gly193, deoarece acestea sunt implicate în mod normal în orientarea substratului. Aceste posibilități se rematină ca prim candidați într-o schemă universală de inactivitate a zimogenilor asemănători tripsinogenului.
pancreasul secretă chimogeni parțial pentru a împiedica enzimele să digere proteinele din celulele în care sunt sintetizate. Enzimele precum pepsina sunt create sub formă de pepsinogen, un zymogen inactiv. Pepsinogenul este activat atunci când celulele principale îl eliberează în acidul gastric, al cărui acid clorhidric îl activează parțial. Un alt pepsinogen parțial activat completează activarea prin îndepărtarea peptidei, transformând pepsinogenul în pepsină. Activarea accidentală a chimogenilor se poate întâmpla atunci când conducta de secreție din pancreas este blocată de o piatră biliară care duce la pancreatită acută.
ciupercile secretă, de asemenea, enzime digestive în mediu ca chimogeni. Mediul extern are un pH diferit decât în interiorul celulei fungice și acest lucru schimbă structura zymogenului într-o enzimă activă.un alt mod în care enzimele pot exista în forme inactive și mai târziu pot fi convertite în forme active este prin activarea numai atunci când un cofactor, numit coenzima, este legat. În acest sistem, forma inactivă (apoenzima) devine forma activă (holoenzima) atunci când coenzima se leagă.