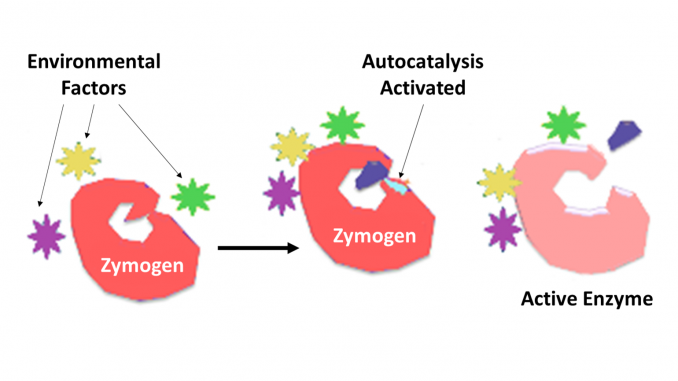
Zimogeno, detta anche del proenzima, qualsiasi di un gruppo di proteine che non visualizza l’attività catalitica ma sono trasformato in un organismo in enzimi, in particolare quelli che catalizzano reazioni che coinvolgono la ripartizione delle proteine. Il cambiamento biochimico di solito si verifica nei corpi di Golgi, dove una parte specifica dell’enzima precursore viene scissa per attivarla. Il pezzo inattivante che viene scisso può essere un’unità peptidica o può essere indipendente piegando domini comprendenti più di 100 residui. Sebbene limitino la capacità dell’enzima, queste estensioni n-terminali dell’enzima o un “prosegment” spesso aiutano a stabilizzare e piegare l’enzima che inibiscono.
Ora è ben riconosciuto che gli enzimi proteolitici svolgono ruoli chiave nella regolazione o nel controllo dell’azione di altre proteine. Tali enzimi possono essere trovati in tutte le specie, dai batteri all’uomo e nel controllo di diversi sistemi, che includono la produzione di ormoni, l’assemblaggio di batteriofagi, lo sviluppo, la fecondazione, la digestione, la difesa contro gli organismi invasori e la riparazione dei tessuti. Nella maggior parte dei casi gli enzimi proteolitici sono noti per essere sintetizzati come precursori inattivi proenzimi, o zymogens. Sono attivati dalla scissione proteolitica di un singolo legame peptidico nel proenzima e quindi diventano cataliticamente attivi. Un ulteriore controllo sul grado di specificità per una molecola o molecole bersaglio è determinato dal grado di specificità inerente all’enzima. Un ulteriore controllo sul tempo e sulla posizione dell’azione è spesso effettuato da inibitori proteici della specificità richiesta.
La struttura del tripsinogeno è generalmente molto più vicina a quella di tripsina che è chymotrypsinogen per chimotripsina, La struttura del tripsinogeno non esclude la possibilità di legame del substrato in un modo simile a quello trovato per la tripsina, anche se i cambiamenti nella struttura di questa regione di contribuire a un’alterata o substrato alterato modalità di associazione-di certo per benzamidine e, probabilmente, anche per un substrato lato catena, Se del proenzima è considerato rigido, quindi il catalizzatore base generale e oxyanion sito di legame formata da N-H gruppi di Gly193 e Ser195 sono troppo distanti cooperare nell’idrolisi del substrato. Anche se la struttura del proenzima dovesse cambiare sul legame al substrato, come sembra probabile, il legame non produttivo può fornire un altro componente importante per l’inattività di zymogen. Tale legame potrebbe ancora lasciare una distanza troppo grande, o un’interazione sfavorevole, tra il substrato e gli elementi del centro catalitico. La posizione alterata della catena tra Lys188A e Ser195 e la catena principale tra Trp215 e Ser217 potrebbe essere responsabile del legame al substrato competitivo ma non produttivo, così come il gruppo N-H di Gly193 poiché sono normalmente coinvolti nell’orientare il substrato. Queste possibilità rematin come candidati principali in uno schema universale per inattività del tripsinogeno-come zymogens.
Il pancreas secerne gli zimogeni in parte per impedire agli enzimi di digerire le proteine nelle cellule in cui sono sintetizzati. Enzimi come la pepsina sono creati sotto forma di pepsinogeno, uno zimogeno inattivo. Il pepsinogeno viene attivato quando le cellule principali lo rilasciano nell’acido gastrico, il cui acido cloridrico lo attiva parzialmente. Un altro pepsinogeno parzialmente attivato completa l’attivazione rimuovendo il peptide, trasformando il pepsinogeno in pepsina. L’attivazione accidentale di zymogens può accadere quando il condotto di secrezione nel pancreas è bloccato da un calcoli biliari con conseguente pancreatite acuta.
I funghi secernono anche enzimi digestivi nell’ambiente come zimogeni. L’ambiente esterno ha un pH diverso rispetto all’interno della cellula fungina e questo cambia la struttura dello zimogeno in un enzima attivo.
Un altro modo in cui gli enzimi possono esistere in forme inattive e successivamente essere convertiti in forme attive è attivando solo quando un cofattore, chiamato coenzima, è legato. In questo sistema, la forma inattiva (l’apoenzima) diventa la forma attiva (l’oloenzima) quando il coenzima si lega.