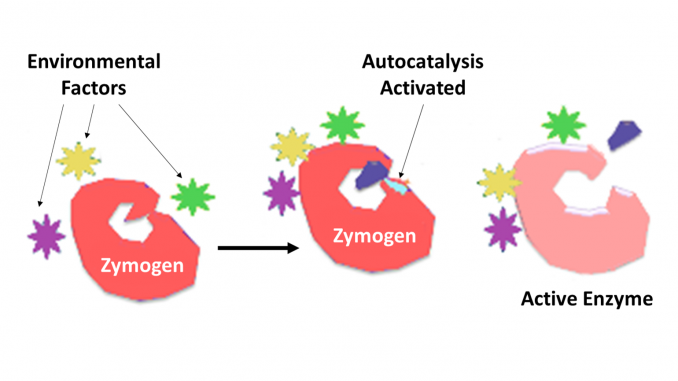
Zymogen, ook wel Pro-enzym genoemd, elk van een groep eiwitten die geen katalytische activiteit vertonen maar binnen een organisme worden omgezet in enzymen, met name die welke reacties katalyseren waarbij eiwitten worden afgebroken. De biochemische verandering komt meestal voor in Golgi-lichamen, waar een specifiek deel van het precursorenzym wordt gesplitst om het te activeren. Het inactiverende stuk dat weg wordt gespleten kan een peptide eenheid zijn, of kan onafhankelijk vouwend domeinen zijn die meer dan 100 residuen omvatten. Hoewel ze het vermogen van het enzym beperken, helpen deze N-terminale uitbreidingen van het enzym of een “prosegment” vaak bij het stabiliseren en vouwen van het enzym dat ze remmen.
Het wordt nu algemeen erkend dat proteolytische enzymen een sleutelrol spelen in de regulatie van of controle over de werking van andere eiwitten. Dergelijke enzymen kunnen in alle species van bacteriën aan mens en in controle van diverse systemen worden gevonden, die hormoonproductie, bacteriofaagassemblage, ontwikkeling, bemesting, spijsvertering, defensie tegen binnenvallende organismen, en weefselreparatie omvatten. In de meeste gevallen zijn de proteolytische enzymen gekend om als inactieve voorloper proenzymes, of zymogens worden samengesteld. Zij worden geactiveerd door proteolytic splitsing van één enkele peptide band in het proenzyme en zo katalytisch actief worden. De verdere controle over de graad van specificiteit voor een doelmolecule of molecules wordt bepaald door de graad van specificiteit inherent aan het enzym. De verdere controle over de tijd en de plaats van actie wordt vaak uitgevoerd door eiwitinhibitors van de vereiste specificiteit.
De structuur van trypsinogeen is over het algemeen veel dichter bij die van trypsine dan is chymotrypsinogen te chymotrypsine, De structuur van trypsinogeen sluit de mogelijkheid niet uit van substraat binden in een modus die vergelijkbaar is met die voor trypsine, hoewel de veranderingen in de structuur van deze regio dragen bij aan een verminderde of veranderde substraat bindend mode-zeker voor benzamidine en waarschijnlijk voor een ondergrond kant keten, Als de proenzyme wordt beschouwd als te rigide, dan is de algemene basis katalysator en het oxyanion bindend site gevormd door de N-H groepen van Gly193 en Ser195 te ver uit elkaar samenwerken bij substraathydrolyse. Zelfs als de pro-enzymestructuur op substraatbinding zou moeten veranderen, zoals waarschijnlijk lijkt, kan de nietproductieve binding een andere belangrijke component voor zymogen-inactiviteit verstrekken. Dergelijke binding kan nog steeds te grote afstand, of een ongunstige interactie, tussen het substraat en elementen van het katalytische centrum. De gewijzigde positie van de keten tussen Lys188a en Ser195 en de hoofdketen tussen Trp215 en Ser217 zou verantwoordelijk kunnen zijn voor concurrerende maar niet-productieve substraatbinding, net als de N-H-groep van Gly193, aangezien zij normaal betrokken zijn bij het oriënteren van het substraat. Deze mogelijkheden rematin als eerste kandidaten in een universeel schema voor inactiviteit van de trypsinogeen-achtige zymogenen.
de alvleesklier scheidt zymogenen gedeeltelijk af om te voorkomen dat de enzymen eiwitten verteren in de cellen waarin ze worden gesynthetiseerd. Enzymen zoals pepsine worden gecreëerd in de vorm van pepsinogeen, een inactieve zymogen. Pepsinogeen wordt geactiveerd wanneer de hoofdcellen het in het maagzuur afgeven, waarvan het zoutzuur het gedeeltelijk activeert. Een ander gedeeltelijk geactiveerd pepsinogeen voltooit de activering door peptide te verwijderen, die pepsinogeen in pepsine draaien. Accidentele activering van zymogens kan gebeuren wanneer de afscheiding kanaal in de alvleesklier wordt geblokkeerd door een galsteen resulteert in acute pancreatitis.
schimmels scheiden ook spijsverteringsenzymen af in het milieu als zymogenen. Het externe milieu heeft een andere pH dan binnen de schimmelcel en dit verandert de structuur van zymogen in een actief enzym.
een andere manier waarop enzymen in inactieve vormen kunnen bestaan en later omgezet kunnen worden in actieve vormen is door alleen te activeren wanneer een co-factor, een co-enzym genoemd, gebonden is. In dit systeem, wordt de inactieve vorm (het apoenzyme) de actieve vorm (het holoenzyme) wanneer het coenzyme bindt.