A Microbial Biorealm page on the genus Citrobacter freundii
Classification
Higher order taxa
Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Citrobacter
Species
NCBI: Taxonomy
Citrobacter Freundii
Description and significance
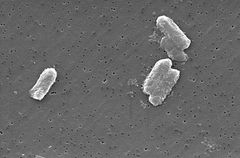 Photo: Pete Wardell / CDC
Photo: Pete Wardell / CDC
Die Citrobacter-Arten, einschließlich Citrobacter freundii, sind aerobe gramnegative Bazillen. Citrobacter freundii sind lange stäbchenförmige Bakterien, die typischerweise 1-5 µm lang sind . Die meisten C. freundii-Zellen sind von vielen Flagellen umgeben, die sich bewegen, aber einige sind nicht beweglich. Sein Lebensraum umfasst die Umwelt (Boden, Wasser, Abwasser), Nahrung und den Darmtrakt von Tieren und Menschen . Es gehört zur Familie der Enterobacteriaceae.
Als opportunistischer Erreger ist C. freundii für eine Reihe bedeutender opportunistischer Infektionen verantwortlich. Es ist bekannt, dass es die Ursache für eine Vielzahl von nosokomialen Infektionen der Atemwege, der Harnwege, des Blutes und mehrerer anderer normalerweise steriler Stellen bei Patienten ist . C. freundii macht etwa 29% aller opportunistischen Infektionen aus . Einer der Hauptgründe, warum viele verschiedene Stämme und Plasmide des C. freundii-Genoms sequenziert werden, ist daher, Antibiotika zu finden, die diese opportunistischen Infektionen bekämpfen können.
Überraschenderweise spielt diese infektiöse Mikrobe beim Menschen eine positive Rolle in der Umwelt. C. freundii ist verantwortlich für die Reduzierung von Nitrat zu Nitrit in der Umwelt . Diese entscheidende Umwandlung ist eine wichtige Stufe im Stickstoffkreislauf. Und das Recycling von Stickstoff ist sehr wichtig, da die Erdatmosphäre zu etwa 85% aus Stickstoff besteht . Daher ist aufgrund seines wichtigen Beitrags zur Umwelt eine weitere Motivation für die Sequenzierung des Genoms von C. freundii.Die Gattung Citrobacter wurde 1932 von Werkman und Gillen entdeckt. Kulturen von C. freundii wurden im selben Jahr aus Bodenextrakten isoliert und identifiziert .
Genomstruktur
Es liegen keine Informationen über das komplette Genom von C. freundii online vor, obwohl einige einzelne Stämme und Plasmide der Mikrobe sequenziert wurden. Das prominenteste ist das Plasmid pCTX-M # 3, da es das größte Plasmid ist und eine große Menge an Proteinen codiert. Seine Sequenz wurde am 6. Januar 2005 abgeschlossen. Es ist ein zirkuläres DNA-Plasmid und es ist 89.468 Nukleotidbasenpaare lang. Die Länge des Plasmids beträgt 0,089468 (Mbp). Es besteht aus 51,0% GC-Gehalt und kodiert 105 Proteine.
Ein weiteres wichtiges Merkmal des C. freundii Genom ist, dass es die einzige Mikrobe in der Familie der Enterobacteriaceae ist, die ein Plasmid enthält, das L-Methionin γ-Lyase (MGL) kodiert. Die Nukleotidsequenz des Plasmids enthält ein 3000 bp langes EcoRI-Insert. Das Fragment enthält auch zwei offene Leserahmen. Der erste Rahmen besteht aus 1.194 Nukleotiden und der zweite aus 1.296 Nukleotiden.Der erste Rahmen, bekannt als das megL-Gen, kodiert ein Protein mit 398 Aminosäureresten, das eine Sequenzhomologie mit MGLs aus verschiedenen Quellen aufweist. Der zweite Rahmen kodiert ein Protein mit Sequenzhomologie mit Proteinen, die zur Familie der Permeasen gehören .
Das C. freundii OS60 AmpC β-lactamase-Gen wurde ebenfalls sequenziert und besteht aus 1197 Nukleotiden. Es kodiert für eine 380 Aminosäure lange Vorstufe und enthält ein 19-Rest-Signalpeptid am 5′-Ende . Dieses Gen kodiert ein reifes Protein mit einer Molekülmasse von 39 781 Dalton. Die Aminosäurepositionen in diesen Vorläufern sind suprisinlgy identisch mit Resten in den E. coli K12 chromosomalen AmpC β-Lactamasen .
Ein weiterer wichtiger Stamm im Genom von C. freunii ist GN346, ein klinisches Isolat, das 1965 gewonnen wurde. Dieser Stamm produziert das Enzym Cephalosporinase, das die Fähigkeit hat, die Anibitoika Cephalosporine und Cephamycine zu hydrolysieren und zu inaktivieren . Die Struktur- und Promotorregionen des Cephalosporinase-Gens sind 1408 Nukleotide lang. Die Aminosäuresequenz des reifen Enzyms besteht aus 361 Aminosäuren mit einer Molekülmasse von 39.878 Da .
Zellstruktur und Stoffwechsel
Die Zellstruktur von C. freunddi ist lang und stäbchenförmig in der Regel 1-5 µm lang. Die Außenseite der Zelle enthält viele Flagellen, die für die Motalität verwendet werden . Da C. freundii gramnegative Bakterien sind, enthält es zwei Membranen (innen und außen).Der periplasmatische Raum liegt zwischen den beiden Membranen. Die äußere Membran enthält keine Energiequelle; Aber es enthält viele Porine, die dem Organismus helfen, wichtige Ionen zu gewinnen . Im Gegensatz zu grampositiven Bakterien enthalten C. freundii-Zellen keine dicke Zellwand aus Peptidoglycan. Für den Stoffwechsel hat C. freundii eine erstaunliche Fähigkeit, auf Glycerin als einzige Kohlenstoff- und Energiequelle zu wachsen. Bei diesem Verfahren wird Glycerin durch einen Dismutationsprozess fermentiert. Dieser Prozess erfordert zwei Wege . Im ersten Weg wird Glycerin durch eine NAD1-gebundene Glycerindehydrogenase zu Dihydroxyaceton dehydriert. Das Dihydroxyaceton wird dann phosphoryliert und durch Dihydroxyacetonkinase zur Glykolyse geleitet. Im zweiten Weg wird Glycerin durch die Coenzym B12-abhängige Glycerindehydratase dehydriert, um 3-Hydroxypropionaldehyd zu bilden . Dieses Produkt wird durch die NADH-gebundene 1,3-Propandioldehydrogenase, die NAD1 regeneriert, zum Hauptfermentationsprodukt 1,3-Propandiol reduziert. Das Dha-Regulon kodiert die vier essentiellen Enzyme dieser beiden Wege. Erstaunlicherweise wird die Expression des Dha-Regulons nur induziert, wenn Glycerin vorhanden ist .
Zellen von C. freundii sind auch in der Lage, Lactose oder Citrat als Kohlenstoffquelle zu metabolisieren .
Ökologie
Citrobacter freundii kommen häufig in der Umwelt vor, hauptsächlich in Boden, Wasser und Abwasserkanälen. Sie sind ein Indikator für eine mögliche Kontamination von Wasser. Sie kommen auch an verschiedenen Organen kranker Tiere vor, darunter Säugetiere, Vögel, Reptilien und Amphibien . Es ist nicht bekannt, dass sie mit anderen Organellen interagieren.
In der Umwelt kann C. freundii Nitrat oder das Ammoniumion (ein Stickstoffatom in Kombination mit vier Wasserstoffatomen) in Nitrit umwandeln; Diese Reaktion findet sowohl in der Umwelt als auch im Verdauungstrakt von Menschen und anderen Tieren statt . Nachdem es Nitrat in der Umwelt in Nitrit umgewandelt hat, wird das Nitrit in Stickstoff umgewandelt, und dieser letzte Schritt vervollständigt den Stickstoffkreislauf in der Erdatmosphäre, der zu 85% aus Stickstoff besteht . Zur ökologischen Rolle dieses Organismus gehört nicht nur seine wichtige Rolle im Stickstoffkreislauf, da er durch den Aufbau von Phosphatkomplexen auch Uran (das Grundmaterial für die Kerntechnologie) anreichern kann .
Citrobacter freundii wurde auch auf den biologischen Abbau von Gerbsäure untersucht, die in Gerbereien verwendet wird .
Pathologie
Citrobacter freundii ist als opportunistischer Erreger häufig die Ursache für signifikante opportunistische Infektionen, was bedeutet, dass er bei gesunden menschlichen Wirten im Allgemeinen keine Krankheit verursacht. Sie betreffen nur Patienten mit einem schwachen Immunsystem, was bedeutet, dass sie eine „Gelegenheit“ benötigen, die Person zu infizieren . Daher ist bekannt, dass Citrobacter-Arten bei Patienten mit einem unterdrückten Immunsystem eine Vielzahl von nosokomialen Infektionen der Atemwege, der Harnwege und des Blutes verursachen . Leber-, Gallen- und Pankreaserkrankungen sind ebenfalls häufige Erkrankungen, die durch C. freundii verursacht werden. Die Gallenwege sind die häufigste Infektionsstelle durch die C. freundii-Bazillen .Eine tödliche Krankheit, mit der C. freundii in Verbindung gebracht wurde, ist die neonatale Meningitis. Neonatale Meningitis ist die Entzündung der Hirnhäute (das System der Membranen, die das ZNS umgeben) aufgrund einer bakteriellen Invasion . Die Sterblichkeitsrate der Citrobacter-Meningitis ist inakzeptabel hoch, wobei die Sterblichkeitsraten der Patienten zwischen 25 und 50% liegen. Darüber hinaus bestehen bei 75% der Überlebenden immer noch schwerwiegende neurologische Probleme. Bei dieser Krankheit kann Citrobacter freundii die Blut-Hirn-Schranke durchdringen, die aus dem Plexus choroideus-Epithel und dem Kapillarendothel des Gehirns besteht .
Tests durchgeführt von Badger et. al in dem Artikel „Citrobacter freundii dringt in mikrovaskuläre Endothelzellen des menschlichen Gehirns ein und repliziert sie“legen nahe, dass die bakterielle Proliferation von C. freundii auf intrazellulärer Ebene stattfindet, was dem allgemeinen wissenschaftlichen Gedanken zuwiderlief. Die Ergebnisse deuten darauf hin, dass C. freundii Vakuolen durchquert, repliziert und in die basolaterale Seite der mikrovaskulären Endothelzellen des menschlichen Gehirns (HBMEC) freigesetzt wird, um die Blut-Hirn-Schranke zu überwinden. Weitere Analysen können möglicherweise therapeutische Strategien zur Behandlung von Infektionen ermöglichen. Es gibt noch keine therapeutische Behandlung .
Bestimmte Krankheiten, die bei Forellen und Cypriniden untersucht wurden, werden auch durch C. freundii verursacht. C. freundii verursacht abnormale entzündliche Veränderungen im Darm von Forellen und entzündliche und nekrotische Veränderungen in den inneren Organen von Cypriniden. Die Krankheit wurde durch künstliche Infektion mit einer Reinkultur von C. freundii entdeckt. Diese Entdeckung etablierte C. freundii als Ursache für Fischkrankheiten .In einer Fallstudie des Journal of Medical Microbiology entwickelte ein Patient eine Peritonitis und eine Tunnelinfektion aufgrund von Citrobacter freundii, was ungewöhnlich ist. Der Patient wurde kontinuierlich ambulant peritonealdialysiert. In der Regel sind die Erreger grampositive Mikroorganismen, insbesondere Staphylococcus aureus und Staphylococcus edpidermis. Auch gibt es keine bekannten Berichte über Tunnel-Infektion durch C. freundii. Die anfängliche Antibiotikatherapie funktionierte nicht und die Infektion blieb bestehen, bis der Katheter entfernt wurde. Dies ist klinisch signifikant, da Citrobacter Freundii eine unterschiedliche Antibiotika-Empfindlichkeit aufweisen, weshalb die initiale Therapie nicht erfolgreich war. Der Patient reagierte nicht auf die Behandlung, bis der Katheter entfernt wurde Citrobacter freundii sind opportunistische Erreger, die hospitalisierte und immungeschwächte Patienten betreffen .
Anwendung in der Biotechnologie
In der Biotech-Industrie produziert Citrobacter freundii viele wichtige Enzyme.Das erste Enzym, das es produziert, ist Phosphatase. Phosphatase-Aktivität von C. es wurde postuliert, dass freundii an der Bleiakkumulation beteiligt ist, die in der Biotech-Industrie eine wichtige Rolle spielen kann. Es wurde auch festgestellt, dass die Phosphataseaktivität von C. freundii gegenüber einigen diagnostischen Reagenzien resistent ist .
Die Reinigung und Charakterisierung von bakterieller Selenocystein-Beta-Lyase, einem Enzym, das spezifisch die Spaltung von L-Selenocystein zu L-Alanin katalysiert, wurde aus Citrobacter freundii gereinigt. Das Enzym ist monomerartig mit einem Molekulargewicht von ca. 64 000 und enthält 1 Mol Pyridoxal-5′-phosphat als Cofaktor pro Mol Enzym. Das Enzym katalysiert auch die Alpha-, Beta-Eliminierung von Beta-Chlor-L-Alanin unter Bildung von NH3, Pyruvat .
C. Freundii-Stämme tragen auch ein Plasmid, das für AmpC-Cephalosporinase der Klasse 1 kodiert. Diese Enzyme können neue Cephamycine und Cephalosporine hydrolzye inaktivieren .
Aktuelle Forschung
Kürzlich wurde an der University of Tennessee, Knoxville, eine kleine Studie zu bestimmten Stämmen von C. freundii durchgeführt. Die Bedeutung bestimmter Tetracyclin- und Streptomycin-Resistenzgene und Klasse-1-Integrone in C. freundii, isoliert aus Milchviehbetrieben und Nichtmilchböden, wurden bewertet. Ein Stamm von C. freundii, der aus Böden von Milchviehbetrieben extrahiert wurde, trug Integrone der Klasse 1 mit verschiedenen eingefügten Genkassetten. Die Ergebnisse dieser kleinen Studie legen nahe, dass das Vorhandensein mehrerer Resistenzgene und Klasse-1-Integrone in C. freundii im Boden von Milchviehbetrieben als Reservoir für antimikrobielle Resistenzgene dienen und eine Rolle bei der Verbreitung dieser antimikrobiellen Resistenzgene auf andere kommensale und indigene mikrobielle Gemeinschaften im Boden spielen könnte. Es sind jedoch zusätzliche längerfristige Studien erforderlich, die an mehreren Standorten durchgeführt wurden, um diese Hypothese zu stützen .
Eine zweite Studie zu C. freundii wurde durchgeführt, um eine Polymerase-Kettenreaktion (PCR) -Methode zu entwickeln, die gleichzeitig drei Paare spezifischer Primer verwendet, um Gene bestimmter Mikroben (einschließlich C. freundii) nachzuweisen. Die Methode umfasste das Entwerfen von drei Primerpaaren: SPVC-1 und SPVC-2, INVA-1 und INVA-2; und VIAB-1 und VIAB-2. Die PCR wurde unter Verwendung dieser drei Primer durchgeführt, um 14 klinisch wichtige bakterielle Organismen zu identifizieren. Die folgenden Stämme wurden unter Verwendung der PCR schnell identifiziert: (1) C. freundii; (2) S. Typhi; und S. Paratyphi C; (3) S. Dublin (Virulenzantigen-positiv); und (4) Salmonellenserovare, die ein Virulenzplasmid vom spv-Typ beherbergen. Obwohl diese PCR-Methode neu ist, kann diese Methode mit dem Fortschritt der Technologie in der Zukunft die Identifizierung von C. freundii in Säugetieren sofort ermöglichen, so dass eine geeignete Antibiotikabehandlung unverzüglich eingeleitet werden kann .
Eine dritte Studie zu C.freundii wurde an der Universität Barcelona, Spanien, durchgeführt. Die Mechanismen der Resistenz gegen Fluorchinolone in zwei Citrobacter freundii-Stämmen wurden untersucht. Beide Stämme wurden von demselben Patienten isoliert. Diese Studie ermöglichte eine teilweise Charakterisierung der ACRA- und acrB-Gene dieses Mikroorganismus. Die Expression von Genen in beiden Stämmen wurde mit DNA-Microarrays auf Escherichia coli analysiert. Die Nukleotidähnlichkeit zwischen den teilweise sequenzierten ACRA- und acrB-Genen von C. freundii und E. coli betrug 80,7% bzw. 85%. Die ACRA- und acrB-Gene von C. freundii sind denen in E ähnlich. coli und ihre Überexpression können eine wichtige Rolle bei der Modulation der endgültigen minimalen Hemmkonzentration von Fluorchinolonen spielen .
Eine vierte Studie zu C. freundii wurde in Taiwan durchgeführt. Ein Forscherteam isolierte einen Diabetiker, der eine nekrotisierende Fasziitis entwickelte, die durch C. freundii verursacht wurde, aus einer Verletzung, die von einem Meerestier ausgelöst wurde. Nekrotisierende Fasziitis ist eine Infektion in der tieferen Schicht der Haut und des Unterhautgewebes. Bei der Behandlung des Patienten nahmen sie eine Probe aus der Flüssigkeit in der Wunde und fanden C. freundii. Nach dreitägigem Beginn der Antibiotikabehandlungen mit Cefotaxmin und Cefepmin kam es zu einer Ansammlung von subkutanen Abszessen. Nach 6, 10, 14 und 21 Tagen der Pflege des Patienten gaben einige Antibiotika dem Patienten eine gewisse Erleichterung, aber es wurde keine langfristige Genesung erreicht. Cefotoaxim, Cefepim, Ciprofloxamin gehören zu den Antibiotika, die C. freundii nicht gewachsen waren. Der Patient erholte sich nach 42 Tagen Ertapenem-Behandlung vollständig. Die Forscher hatten zwei Kolonien von C. freundii innerhalb von 5 Tagen voneinander isoliert. Als die Isolate gezüchtet wurden, wurden sie immens resistent gegen Cefotaxim und Cefepim. Der Grund, warum entrapenem gegen C. freundii wirkt, ist, dass es gegen AmpC-produzierende Enterobacteriaceae wirksam ist .
Antibiotikaresistenz
Citrobacter-Arten sind eine häufige Ursache für nosokomiale Infektionen bei Patienten, die sich einer längeren Krankenhausbehandlung unterziehen. Es wurde kürzlich berichtet, dass C. freundii Resistenzen gegen Breitbandantibiotika wie Piperacillin, Piperacillintazobactam, Vancomycin und Cephalosporine exprimiert. Die Isolierung von Ceftriaxonresistentem Citrobacter freundii (CRCF) wurde mit den überverschriebenen Breitbandantibiotika in Verbindung gebracht. Die aufkommenden neuen CRCF-Stämme könnten auf die Induktion oder Depression von Resistenzgenen sowie auf die Eliminierung konkurrierender Organismen hindeuten. CRCF wurde größtenteils von Patienten mit signifikanten Komorbiditäten wie AIDS, peripheren Gefäßerkrankungen und zerebrovaskulären Erkrankungen isoliert. Es wurde auch berichtet, dass die Verwendung von Fluorchinolon keinen Einfluss auf die Isolierung von CRCF hat.Es ist auch bekannt, dass Citrobacter freundii in seinem Chromosom ein für Cephalosporinase kodierendes Gen enthält. Dieses Enzym hydrolysiert -CO-NH- Bindung im Lactam-Ring von Cephalosporinen und cephamycis wodurch die Bakterien resistent gegen diese Art von Antibiotika. Bei Exposition gegenüber neuen Cephemen und Cerbapenemen der dritten Generation zeigte klinisch isoliertes C.freundii jedoch eine Empfindlichkeit gegenüber diesen Substanzen.Ein kleiner Ausbruch von C.freundii, der gegen Cepheme der dritten Generation resistent ist, wurde in der chirurgischen Abteilung des Nagoya University Hospital bei Patienten beobachtet, die sich chirurgischen Eingriffen unterzogen. Der C. freundii wurde aus Galle, Wundgaze, Kot, Eiter und Aszites des Patienten isoliert. Es wurde vermutet, dass diese neuen Stämme von C. freundii ein Plasmid enthielten, das für AmpC-celphalosporinase kodiert, aber nach dem Versagen, die cephems-Resistenz von C. freundii auf E.coli zu übertragen, wurde der Schluss gezogen, dass das Enzym im Chromosom von C. freundii kodiert sein muss. Da C. freunddi mit nosokomialen Infektionen assoziiert ist, ist Vorsicht bei diesen neuen Stämmen geboten .
1. Wang JT,Chang SC, Chen YC, Luh KT. „Vergleich der antimikrobiellen Empfindlichkeit von Citrobacter freundii-Isolaten in zwei verschiedenen Zeiträumen.“ Das Journal für Mikrobiologie, Immunologie und Infektion. 2000 Dezember; 33(4): 258-62.
2. Whalen JG, Mully TW, Enlgish JC 3. Platz. „Spontane Citrobacter freundii-Infektion bei einem immunkompetenten Patienten.“ Archiv der Dermatologie. 2007 Januar; 143(1): 124-5.
3. Puchenkova SG. „Enterobakterien in Wassergebieten entlang der Krimküste.“ mikrobiolohichnyĭ zhurnal. März-April 1996; 58(2): 3-7.
4.http://www.ncbi.nlm.nih.gov/sites/entrez?db=genomeprj&cmd=Retrieve&dopt=Overview&list_uids=13123
5. Ilja W. Manuchow, Daria W. Mamajewa, Sergej M. Rastorguev, Nicolai G. Faleev, Elena A. Morozova, Tatyana V. Demidkina und Gennadii B. Zavilgelsky. „Ein Gen, das für L-Methionin-γ-Lyase kodiert, ist in den Genomen der Enterobacteriaceae-Familie vorhanden: Identifizierung und Charakterisierung von Citrobacter freundii L-Methionin-γ-Lyase.“ Das Journal der Bakteriologie. 2005 Juni; 187(11): 3889-3893.
6. Lindberg, Frederik; Westman, Lennart; Normark, Staffan. „Regulatorische Komponenten in Citrobacter freundii ampC β -Lactamase-Induktion.“ Proceedings der Nationalen Akademie der Wissenschaften der Vereinigten Staaten von Amerika. Juli 1985; 82(14): 4620-4624.
7. Tsukamoto K, Tachibana K, Yamazaki N, Ishii Y, Ujiie K, Nishida N, Sawai T. „Rolle von Lysin-67 im aktiven Zentrum der Beta-Lactamase der Klasse C aus Citrobacter freundii GN346.“ Europäische Zeitschrift für Biochemie / FEBS. 1990 Februar 22; 188(1): 15-22.
8. Keevil CW, Hough JS, Cole JA. „Prototrophisches Wachstum von Citrobacter freundii und die biochemischen Grundlagen für seine scheinbaren Wachstumsanforderungen in belüfteten Medien.“ Zeitschrift für allgemeine Mikrobiologie. 1997 Januar; 98(1): 273-6.
9. Marco Sánchez F, Turabian Fernández JL, Durán Pérez-Navarro A. „Tödliche Citrobacter Freundii Bronchopneumonie, die in der Gemeinschaft bei einem kompromisslosen Patienten erworben wurde.“Revista Clínica Española. April 1985; 176 (6): 320
10. Produziert von Julie L. Badger, Monique F. Stins und Kwang Sik Kim. „Citrobacter freundii dringt in mikrovaskuläre Endothelzellen des menschlichen Gehirns ein und repliziert sie.“Hinyokika kiyo. In: Acta Urologica Japonica. 1985 Juli; 31(7): 1159-70.
11. Drlichman V, Band JD. „Bakteriämien durch Citrobacter diversus und Citrobacter freundii. Inzidenz, Risikofaktoren und klinisches Ergebnis.“Archiv für Innere Medizin. 1985 Oktober; 145(10): 1808-10.
12. Srinivasan V, Nam HM, Sawant AA, Headrick SI, Nguyen LT, Oliver SP. „Verteilung von Tetracyclin- und Streptomycin-Resistenzgenen und Klasse-1-Integronen in Enterobacteriaceae, die aus Milch- und Nichtmilchböden isoliert wurden.“Mikrobielle Ökologie. 2007 August 15.
13. Sánchez-Céspedes J, Vila J. „Partielle Charakterisierung des acrAB-Locus in zwei Citrobacter freundii klinischen Isolaten.“ Internationale Zeitschrift für antimikrobielle Wirkstoffe. 2007 September; 30(3): 259-63.
14. Ciğerci IH, Korcan SE, Konuk M, Öztürk S. „Vergleich der ALAD-Aktivitäten von Citrobacter- und Pseudomonas-Stämmen und deren Verwendung als Biomarker für Pb-Kontamination.“ Umweltüberwachung und -bewertung. 22. Mai 2007.
15. Chocat P, Esaki N, Tanizawa K, Nakamura K, Tanaka H, Soda K. „Reinigung und Charakterisierung von Selenocystein Beta-Lyase aus Citrobacter freundii.“ Zeitschrift für Bakteriologie. 1985 August; 163(2): 669-76.
16. Inga Mahler. „Phosphatase-Aktivität und Bleiresistenz in Citrobacter freundii und Staphylococcus aureus. In: “ FEMS Microbiology Letters. April 1998; 161(1): 135-138.
17. Murakami K, Yoshida T. „Kovalente Bindung von Moxalactam an Cephalosporinase von Citrobacter freundii.“ Antimikrobielle Mittel und Chemotherapie. 1985 Mai; 27(5): 727-32.
18. Dervisoglu, E., Yegenaga, I., Yumuk, Z. „Citrobacter Freundii Peritonitis und Tunnelinfektion bei einem Patienten mit kontinuierlicher ambulanter Peritonealdialyse.“ Zeitschrift für medizinische Mikrobiologie, 2008. Band 57. s. 125-127.
19. Kim PW, Harris AD, Roghmann MC, Morris JG Jr, Strinivasan A, Perencevich EN. „Epidemiologische Risikofaktoren für die Isolierung von Ceftriaxon-resistenten versus -anfälligen Citrobacter freundii bei Krankenhauspatienten“ Antimicrob Agents Chemother, 2003 Sep;47(9): p.2882-2887.
20. Nada T, Baba H, Kawamura K, Ohkura T, Torii K, Ohta M. „Ein kleiner Ausbruch der Cephem-resistenten Citrobacter freundii-Infektion der dritten Generation auf einer chirurgischen Station“ Jpn J Infect Dis. 2004 August;57(4): p.181-182.
21. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Chuang, Y., Tseng, S., and Hsueh, P. „Entstehung von Cefotaxim-Resistenz in Citrobactor freundii verursacht nekrotisierende Fasziitis und Osteomyelitis“ Journal of Infection, 2006. Band 53. s. e161-e163.
22.Badger, J., Stins, M. und Sik Kim, K. „Citrobacter freundii dringt in mikrovaskuläre Endothelzellen des menschlichen Gehirns ein und repliziert sie“ Infektion und Immunität, 1999. Volumen 67. S. 4208-4215.
Herausgegeben von Sumaira Akbarzada, Studentin von Rachel larseneditiert von Greg Vargas und Darren Zhen ,Studenten der M Glogowskiat Loyola Universityeditiert von Gergana Grigorova und Michal Olszewski, Studenten der M Glogowskiat Loyola Universityeditiert von Alex Kula und Joanna Aiken, Studenten der M Glogowskiat Loyola University