A Microbial Biorealm page on the genus Citrobacter freundii
Classification
Higher order taxa
Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Citrobacter
Species
NCBI: Taxonomy
Citrobacter Freundii
Description and significance
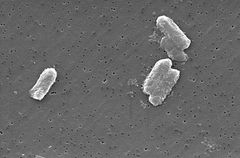 Photo: Pete Wardell / CDC
Photo: Pete Wardell / CDC
Las especies de Citrobacter, incluido Citrobacter freundii, son bacilos gramnegativos aeróbicos. Los Citrobacter freundii son bacterias largas en forma de bastoncillo, típicamente de 1-5 µm de longitud . La mayoría de las células de C. freundii están rodeadas por muchos flagelos que se usan para moverse, pero algunas no son móviles. Su hábitat incluye el medio ambiente (suelo, agua, aguas residuales), los alimentos y el tracto intestinal de animales y humanos . Pertenece a la familia de las Enterobacteriáceas.
Como patógeno oportunista, C. freundii es responsable de una serie de infecciones oportunistas significativas. Se sabe que es la causa de una variedad de infecciones nosocomiales de las vías respiratorias, las vías urinarias, la sangre y varios otros sitios normalmente estériles en los pacientes . C. freundii representa aproximadamente el 29% de todas las infecciones oportunistas . Por lo tanto, una de las principales razones por las que se están secuenciando muchas cepas y plásmidos diferentes del genoma de C. freundii es para encontrar antibióticos que puedan combatir estas infecciones oportunistas.
Sorprendentemente, este microbio infeccioso en los seres humanos juega un papel positivo en el medio ambiente. C. freundii es responsable de reducir el nitrato a nitrito en el medio ambiente . Esta conversión crucial es una etapa importante en el ciclo del nitrógeno. Y reciclar nitrógeno es muy esencial porque la atmósfera de la Tierra es de aproximadamente 85% de nitrógeno . Por lo tanto, debido a su importante contribución al medio ambiente es otra motivación para secuenciar el genoma de C. freundii.
El género Citrobacter fue descubierto en 1932 por Werkman y Gillen. Los cultivos de C. freundii se aislaron e identificaron en el mismo año a partir de extractos de suelo .
Estructura del genoma
No hay información disponible en línea sobre el genoma completo de C. freundii, aunque se han secuenciado algunas cepas individuales y plásmidos del microbio. El más prominente es el plásmido pCTX-M # 3 porque es el plásmido más grande y codifica una gran cantidad de proteínas. Su secuencia se completó el 6 de enero de 2005. Es un plásmido de ADN circular y tiene 89.468 pares de bases de nucleótidos de largo. La longitud del plásmido es de 0,089468 (Mbp). Se compone de 51,0% de contenido de GC, y codifica 105 proteínas .
Otra característica importante de la C. el genoma de freundii es que es el único microbio de la familia Enterobacteriaceae que contiene un plásmido que codifica la Γ-liasa de L-metionina (MGL). La secuencia de nucleótidos del plásmido contiene un inserto EcoRI largo de 3000 pb . El fragmento también contiene dos marcos de lectura abiertos. El primer marco consta de 1.194 nucleótidos, y el segundo, de 1.296 nucleótidos.El primer marco, conocido como el gen megL, codifica una proteína de 398 residuos de aminoácidos que tiene homología de secuencia con MGL de diferentes fuentes. El segundo marco codifica una proteína con homología de secuencia con proteínas pertenecientes a la familia de las permeasas .
El gen β-lactamasa C. freundii OS60 AMPc también se ha secuenciado y está compuesto por 1197 nucleótidos. Codifica un precursor largo de 380 aminoácidos y contiene un péptido señal de 19 residuos en el extremo 5′. Este gen codifica una proteína madura que tiene una masa molecular de 39 781 Daltons. Las posiciones de aminoácidos en estos precursores son sorprendentemente idénticas a los residuos en las β-lactamasas AMPc cromosómicas de E. coli K12 .
Otra cepa importante en el genoma de C. freunii es GN346, que es un aislado clínico recuperado en 1965. Esta cepa produce la enzima cefalosporinasa, que tiene la capacidad de hidrolizar e inactivar las cefalosporinas y las cefamicinas anibitóicas . Las regiones estructurales y promotoras del gen de la cefalosporinasa tienen 1408 nucleótidos de longitud. La secuencia de aminoácidos de la enzima madura, se compone de 361 aminoácidos con una masa molecular de 39,878 Da .
Estructura celular y metabolismo
La estructura celular de C. freundi es larga y en forma de varilla, generalmente de 1-5 µm de longitud. El exterior de la célula contiene muchos flagelos utilizados para la movilidad . Dado que C. freundii es una bacteria gramnegativa, contiene dos membranas (interna y externa).El espacio periplasmático se encuentra entre las dos membranas. La membrana externa no contiene una fuente de energía, pero sí contiene muchas porinas incrustadas dentro que ayudan al organismo a adquirir iones importantes . A diferencia de las bacterias grampositivas, las células de C. freundii no contienen una pared celular gruesa compuesta de peptidoglicano.
Para el metabolismo, C. freundii tiene una increíble capacidad de crecer con glicerol como única fuente de carbono y energía. En este proceso, el glicerol se fermenta mediante un proceso de dismutación. Este proceso requiere dos vías . En la primera vía, el glicerol es deshidrogenado por una glicerol deshidrogenasa ligada a NAD1 a dihidroxiacetona. La dihidroxiacetona es fosforilada y canalizada a glicólisis por la dihidroxiacetona quinasa . En la segunda vía, el glicerol es deshidratado por la deshidratasa de glicerol dependiente de la coenzima B12 para formar 3-hidroxipropionaldehído . Este producto se reduce al producto principal de fermentación 1,3-propanodiol por la deshidrogenasa 1,3-propanodiol ligada al NADH, que regenera el NAD1. El dha regulon codifica las cuatro enzimas esenciales de estas dos vías. Sorprendentemente, la expresión del regulador de dha solo se induce cuando hay glicerol presente .
Las células de C. freundii también son capaces de metabolizar lactosa o citrato como fuente de carbono .
Ecología
Los Citrobacter freundii se encuentran comúnmente en el medio ambiente, principalmente en el suelo, el agua y las alcantarillas. Son un indicador de la posible contaminación del agua. También se encuentran en diferentes órganos de animales enfermos, incluidos mamíferos, aves, reptiles y anfibios . No se sabe que interactúen con otros órganos.
En el medio ambiente, C. freundii puede convertir nitrato o el ion amonio (que es un átomo de nitrógeno combinado con cuatro átomos de hidrógeno) en nitrito; esta reacción se produce en el medio ambiente, así como en el tracto digestivo de los seres humanos y otros animales . Después de convertir nitrato en nitrito en el medio ambiente, el nitrito se convierte en nitrógeno, y este paso final completa el ciclo de nitrógeno en la atmósfera de la tierra, que se compone de 85% de nitrógeno . El papel ecológico de este organismo no solo incluye su importante papel en el ciclo del nitrógeno, ya que también puede acumular uranio (que es el material básico para la tecnología nuclear) mediante la construcción de complejos de fosfato .
Citrobacter freundii también se ha investigado la biodegradación del ácido tánico utilizado en las curtidurías .
Patología
Como patógeno oportunista, Citrobacter freundii es a menudo la causa de infecciones oportunistas significativas, lo que significa que generalmente no causa enfermedad en huéspedes humanos sanos. Solo afectan a pacientes con un sistema inmunitario débil, lo que significa que necesitan una «oportunidad» para infectar a la persona . Por lo tanto, en pacientes con un sistema inmunitario deprimido, se sabe que las especies de Citrobacter causan una amplia variedad de infecciones nosocomiales de las vías respiratorias, las vías urinarias y la sangre . Las enfermedades hepáticas, biliares y pancreáticas también son enfermedades comunes causadas por C. freundii. El tracto biliar es el sitio más común de infección por el bacilo de C. freundii .
Una enfermedad mortal con la que se ha asociado C. freundii es la meningitis neonatal. La meningitis neonatal es la inflamación de las meninges (el sistema de membranas que rodean el SNC) debido a la invasión bacteriana . La tasa de mortalidad de la meningitis Citrobacter es inaceptablemente alta, con tasas de mortalidad de pacientes que oscilan entre el 25 y el 50 %. Además, aún persisten problemas neurológicos graves en el 75% de los sobrevivientes. En esta enfermedad, Citrobacter freundii es capaz de penetrar la barrera hematoencefálica que consiste en el epitelio del plexo coroideo y el endotelio capilar cerebral . Pruebas realizadas por Badger et. al en el artículo «Citrobacter freundii Invade y Se Replica en las Células Endoteliales Microvasculares del Cerebro Humano»sugiere que la proliferación bacteriana de C. freundii tiene lugar a nivel intracelular, lo que había sido contrario al pensamiento científico general. Los hallazgos indican que C. freundii atraviesa vacuolas, se replica y se libera en el lado basolateral de las células endoteliales microvasculares del cerebro humano (HBMEC) para cruzar la barrera hematoencefálica. Un análisis adicional puede permitir estrategias terapéuticas para tratar infecciones. Todavía no se dispone de tratamiento terapéutico.
Ciertas enfermedades estudiadas en truchas y ciprínidos también son causadas por C. freundii. C. freundii causa cambios inflamatorios anormales en el intestino de la trucha y cambios inflamatorios y necróticos en los órganos internos de los ciprínidos. La enfermedad se descubrió por medio de una infección artificial con un cultivo puro de C. freundii. Este descubrimiento estableció a C. freundii como una causa de enfermedad de los peces .
En un estudio de caso realizado por el Journal of Medical Microbiology, un paciente desarrolló peritonitis e infección de túnel debido a Citrobacter freundii, que es poco común. El paciente estaba en diálisis peritoneal ambulatoria continua. Por lo general, los agentes causantes son microorganismos grampositivos, particularmente Staphylococcus aureus y Staphyloccus edpidermis. Tampoco hay informes conocidos de infección por túnel debido a C. freundii. La terapia antibiótica inicial no funcionó y la infección continuó hasta que se retiró el catéter. Esto es clínicamente significativo porque Citrobacter Freundii muestra una susceptibilidad diferente a los antibióticos, por lo que la terapia inicial no tuvo éxito. El paciente no respondió al tratamiento hasta que se retiró el catéter, mostrando que Citrobacter freundii son patógenos oportunistas que afectan a pacientes hospitalizados e inmunodeprimidos .
Aplicación a la biotecnología
En la industria biotecnológica, Citrobacter freundii produce muchas enzimas importantes.La primera enzima que produce es la fosfatasa. Actividad fosfatasa de C. se ha postulado que freundii participa en la acumulación de plomo, que puede haber desempeñado un papel importante en la industria biotecnológica. También se ha descubierto que la actividad de la fosfatasa de C. freundii tiene resistencia a algunos reactivos de diagnóstico .
La purificación y caracterización de la selenocisteína beta-liasa bacteriana, una enzima que cataliza específicamente la escisión de L-selenocisteína a L-alanina, se ha purificado de Citrobacter freundii. La enzima es monomérica con un peso molecular de ca. 64.000 y contiene 1 mol de piridoxal 5 ‘ – fosfato como cofactor por mol de enzima. La enzima también cataliza la eliminación alfa y beta de la beta-cloro-L-alanina para formar NH3, piruvato .
Las cepas de C. Freundii también llevan un plásmido que codifica la cefalosporinasa AMPc de clase 1. Estas enzimas pueden hidrolizar inactivar nuevas cefamicinas y cefalosporinas .
Investigación actual
Recientemente se realizó una investigación a pequeña escala sobre ciertas cepas de C. freundii en la Universidad de Tennessee, Knoxville. La importancia de ciertos genes de resistencia a tetraciclinas y estreptomicina e integrones de clase 1 en C. se evaluó freundii aislado de suelos de granjas lecheras y suelos no lácteos. Una cepa de C. freundii extraída de suelos de granjas lecheras llevaba integrones de clase 1 con diferentes casetes de genes insertados. Los resultados de este pequeño estudio sugirieron que la presencia de genes de resistencia múltiple e integrones de clase 1 en C. freundii en el suelo de granjas lecheras puede actuar como un reservorio de genes de resistencia a los antimicrobianos y podría desempeñar un papel en la diseminación de estos genes de resistencia a los antimicrobianos a otras comunidades microbianas comensales e indígenas en el suelo. Sin embargo, se necesitan estudios adicionales a más largo plazo realizados en más lugares para apoyar esta hipótesis .
Se realizó una segunda investigación sobre C. freundii para idear un método de reacción en cadena de la polimerasa (PCR) que utiliza simultáneamente tres pares de cebadores específicos para detectar genes de ciertos microbios (incluido C. freundii). El método incluyó el diseño de tres pares de cebadores que fueron: SPVC-1 y SPVC-2, INVA-1 e INVA-2; y VIAB-1 y VIAB-2. La PCR se realizó utilizando estos tres cebadores para identificar 14 organismos bacterianos clínicamente importantes. Las siguientes cepas se identificaron rápidamente utilizando la PCR: (1) C. freundii; (2) S. Typhi; y S. Paratyphi C; (3) S. Dublin (antígeno de virulencia positivo); y (4) serovares de Salmonella que albergan un plásmido de virulencia tipo spv. Aunque este método de PCR es nuevo, con el avance de la tecnología en el futuro, este método puede permitir la identificación de C. freundii en mamíferos de inmediato para que se pueda iniciar sin demora un tratamiento antibiótico adecuado .
Se realizó un tercer estudio sobre C. freundii en la Universidad de Barcelona, España. Se estudiaron los mecanismos de resistencia a las fluoroquinolonas en dos cepas de Citrobacter freundii. Ambas cepas fueron aisladas del mismo paciente. Este estudio permitió la caracterización parcial de los genes acrA y acrB de este microorganismo. La expresión de genes en ambas cepas se analizó utilizando microarrays de ADN para Escherichia coli. La similitud de nucleótidos entre los genes acrA y acrB parcialmente secuenciados de C. freundii y E. coli fue de 80,7% y 85%, respectivamente. Los genes acrA y acrB de C. freundii son similares a los de E. los coli y su sobreexpresión pueden desempeñar un papel importante en la modulación de la concentración inhibitoria mínima final de fluoroquinolonas .
Se realizó un cuarto estudio sobre C. freundii en Taiwán. Un equipo de investigadores aisló a un paciente diabético que desarrolló fascitis necrotizante causada por C. freundii a partir de una lesión incitada por un animal marino. La fascitis necrotizante es una infección dentro de la capa más profunda de la piel y los tejidos subcutáneos. Al tratar al paciente, tomaron una muestra del líquido de la herida y encontraron a C. freundii. Después de tres días de comenzar los tratamientos con antibióticos con cefotaxmina y cefepmina, hubo acumulación de abscesos subcutáneos. Después de 6, 10, 14 y 21 días de atención al paciente, algunos antibióticos le estaban dando alivio, pero no se alcanzó una recuperación a largo plazo. La cefotoxima, la cefepima y la ciprofloxamina se encuentran entre los antibióticos que no coinciden con C. freundii. El paciente se recuperó completamente después de 42 días de tratamiento con ertapenem. Los investigadores habían aislado dos colonias de C. freundii con 5 días de diferencia. A medida que los aislados fueron creciendo, se volvieron inmensamente resistentes a la cefotaxima y la cefepima. La razón por la que entrapenem trabajó contra C. freundii es porque es activo contra Enterobacteriaceae productoras de AMPc .
Resistencia a los antibióticos
Las especies de Citrobacter son una causa común de infecciones nosocomiales asociadas con pacientes que se someten a tratamientos hospitalarios prolongados. Se ha informado recientemente de que C. freundii expresa resistencia a antibióticos de amplio espectro, como piperacilina, piperacillintazobactam, vancomicina y cefalosporinas. El aislamiento de Citrobacter freundii (CRCF) resistente a ceftriaxona se ha asociado con los antibióticos de amplio espectro recetados en exceso. Las nuevas cepas CRCF emergentes podrían sugerir inducción o depresión de genes de resistencia, así como eliminación de organismos competidores. El CRCF se aisló principalmente de pacientes con comorbilidades significativas, como el SIDA, la enfermedad vascular periférica y la enfermedad cerebrovascular. También se ha informado que el uso de fluoroquinolona no afecta al aislamiento de CRCF .
Citrobacter freundii también es conocido por contener en su cromosoma un gen que codifica la cefalosporinasa. Esta enzima hidroliza−CO− NH-enlace en el anillo lactámico de cefalosporinas y cefamicina, haciendo que las bacterias sean resistentes a este tipo de antibióticos. Sin embargo, cuando se expuso a cefems y cerbapenems de nueva tercera generación, C. freundii clínicamente aislado mostró sensibilidad a esas sustancias.Se ha observado un pequeño brote de C. freundii resistente a los cefems de tercera generación en la sala de cirugía del Hospital Universitario de Nagoya en pacientes sometidos a procedimientos quirúrgicos. El C. freundii se aisló de la bilis, gasa de la herida, heces, pus y ascitis del paciente. Se sugirió que estas nuevas cepas de C. freundii contenían un plásmido que codificaba la celfalosporinasa AMPc, pero al no transferir la resistencia de C. freundii a E. coli, se concluyó que la enzima debía codificarse en el cromosoma de C. freundii. Dado que C. freundi está asociado con infecciones nosocomiales, se recomienda precaución con estas nuevas cepas .
1. Wang JT, Chang SC, Chen YC, Luh KT. «Comparison of antimicrobial susceptibility of Citrobacter freundii isolates in two different time periods.»The Journal of Microbiology, Immunology and Infection. 2000 Dec; 33 (4): 258-62.
2. Whalen JG, Mully TW, Enlgish JC 3rd. «Infección espontánea de Citrobacter freundii en un paciente inmunocompetente.»Archives of dermatology. 2007 Jan; 143 (1): 124-5.
3. Puchenkova SG. «Enterobacteria in areas of water along the Crimean Coast.»mikrobiolohichny zh zhurnal. 1996 Mar-Apr; 58( 2): 3-7.
4.http://www.ncbi.nlm.nih.gov/sites/entrez?db=genomeprj&cmd=Retrieve&dopt=Overview&list_uids=13123
5. Ilya C. Manukhov, Daria C. Mamaeva, Sergei M. Rastorguev, Nicolai G. Faleev, Elena A. Morozova, Tatyana V. Demidkina, y Gennadii B. Zavilgelsky. «A Gene Encoding L-Metionina γ-Liasa Is Present in Enterobacteriaceae Family Genomes: Identification and Characterization of Citrobacter freundii L-Metionina γ-Liasa.»The Journal of Bacteriology. Junio de 2005; 187 (11): 3889-3893.
6. Lindberg, Frederik; Westman, Lennart; Normark, Staffan. «Regulatory Components in Citrobacter freundii AMPc Inducción de β-lactamasa.»Proceedings of the National Academy of Sciences of the United States of America. 1985 July; 82 (14): 4620-4624.
7. Tsukamoto K, Tachibana K, Yamazaki N, Ishii Y, Ujiie K, Nishida N, Sawai T. » Role of lysine – 67 in the active site of class C beta-lactamase from Citrobacter freundii GN346.»European Journal of Biochemistry / FEBS. 1990 Feb 22; 188 (1): 15-22.
8. Keevil CW, Hough JS, Cole JA. «Prototróficas crecimiento de Citrobacter freundii y la base bioquímica para su crecimiento aparente de los requisitos en aireado medios de comunicación.»Journal of General Microbiology. 1997 Jan; 98 (1): 273-6.
9. Marco Sánchez F, Turabian Fernández JL, Durán Pérez-Navarro A. «Fatal Citrobacter Freundii Bronchopneumonia Acquired in the Community in an Uncompromised Patient.” Revista Clínica Española. 1985 Apr; 176(6): 320
10. Julie L. Badger, Monique F. Stins, and Kwang Sik Kim. «Citrobacter freundii Invades and Replicates in Human Brain Microvascular Endothelial Cells.” Hinyokika kiyo. Acta Urologica Japonica. 1985 Jul; 31(7): 1159-70.
11. Drelichman V, Band JD. «Bacteremias due to Citrobacter diversus and Citrobacter freundii. Incidence, risk factors, and clinical outcome.” Archives of Internal Medicine. 1985 Oct; 145(10): 1808-10.
12. Srinivasan V, Nam HM, Sawant AA, Headrick SI, Nguyen LT, Oliver SP. «Distribution of Tetracycline and Streptomycin Resistance Genes and Class 1 Integrons in Enterobacteriaceae Isolated from Dairy and Nondairy Farm Soil.»Microbial Ecology. 15 de agosto de 2007.
13. Sánchez-Céspedes J, Vila J. » Partial characterisation of the acrAB locus in two Citrobacter freundii clinical isolates.»International Journal of Antimicrobial Agents. 2007 Sep; 30 (3): 259-63.
14. Ciğerci IH, Korcan SE, Konuk M, Oztürk S. «Comparison of ALAD activities of Citrobacter and Pseudomonas strains and their usage as biomarker for Pb contamination.»Vigilancia y Evaluación del Medio Ambiente. 22 de mayo de 2007.
15. Chocat P, Esaki N, Tanizawa K, Nakamura K, Tanaka, H, Soda K. «Purificación y caracterización de la selenocisteína beta-liasa de Citrobacter freundii.»Journal of Bacteriology. 1985 Aug; 163 (2): 669-76.
16. Hillel S Levinson, Inga Mahler. «Phosphatase activity and lead resistance in Citrobacter freundii and Staphylococcus aureus.»FEMS Microbiology Letters. 1998 Apr; 161 (1): 135-138.
17. Murakami K, Yoshida T. » Covalent binding of moxalactam to cephalosporinase of Citrobacter freundii.»Agentes Antimicrobianos y Quimioterapia. 1985 May; 27 (5): 727-32.
18. Dervisoglu, E. ,Yegenaga, I., Yumuk, Z. » Citrobacter Freundii peritonitis and tunnel infection in a patient on continuous ambulatory peritoneal dialysis.»Journal of Medical Microbiology, 2008. Volume 57. p. 125-127.
19. Kim PW, Harris AD, Roghmann MC, Morris JG Jr, Strinivasan A, Perencevich EN. «Factores de riesgo epidemiológicos para el aislamiento de citrobacter freundii resistente a ceftriaxona versus susceptible en pacientes hospitalizados» Agentes Antimicrob Chemother, 2003 Sep; 47( 9): p. 2882-2887.
20. Nada T, Baba H, Kawamura K, Ohkura T, Torii K, Ohta M. «A small outbreak of third generation Citrobacter freundii infection on a surgical ward» Jpn J Infect Dis. Agosto de 2004;57 (4): págs. 181 y 182.
21. Chuang, Y., Tseng, S., Teng, L., Ho, Y., and Hsueh, P. «Emergence of cefotaxime resistance in Citrobactor freundii causing necrotizing fascitis and osteomyelitis» Journal of Infection, 2006. Volume 53. p. e161-e163.
22.Badger, J., Stins, M., y Sik Kim, K.» Citrobacter freundii Invades and Replicates in Human Brain Microvascular Endothelial Cells » Infection and Immunity, 1999. Volumen 67. P. 4208-4215.
Editado por Sumaira Akbarzada, estudiante de Rachel Larsen ,editado por Greg Vargas y Darren Zhen, estudiantes de M Glogowskiat Loyola Universityeditado por Gergana Grigorova y Michal Olszewski, estudiantes de M Glogowskiat Loyola Universityeditado por Alex Kula y Joanna Aiken, estudiantes de M Glogowskiat Loyola University