A Microbial Biorealm page on the genus Citrobacter freundii
Classification
Higher order taxa
Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Citrobacter
Species
NCBI: Taxonomy
Citrobacter Freundii
Description and significance
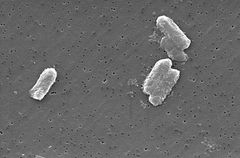 Photo: Pete Wardell/CDC
Photo: Pete Wardell/CDC
De Citrobacter-soorten, waaronder Citrobacter freundii, zijn aerobe gramnegatieve bacillen. Citrobacter freundii zijn lange staafvormige bacteriën die meestal 1-5 µm lang zijn . De meeste C. freundii cellen zijn omgeven door veel flagella gebruikt om te bewegen, maar een paar zijn niet-beweeglijk. Zijn habitat omvat het milieu (bodem, water, riolering), voedsel, en de darmen van dieren en mensen . Het behoort tot de familie van Enterobacteriaceae.
als een opportunistische pathogeen is C. freundii verantwoordelijk voor een aantal significante opportunistische infecties. Het is bekend dat het de oorzaak is van een verscheidenheid aan nosocomiale infecties van de luchtwegen, urinewegen, bloed en verschillende andere normaal steriele plaatsen bij patiënten . C. freundii vertegenwoordigt ongeveer 29% van alle opportunistische infecties . Daarom, wordt één van de belangrijkste redenen vele verschillende spanningen en plasmiden van het genoom van C. freundii gerangschikt is om antibiotica te vinden die deze opportunistische besmettingen kunnen bestrijden.verrassend genoeg speelt deze infectieuze microbe bij de mens een positieve rol in het milieu. C. freundii is verantwoordelijk voor het reduceren van nitraat tot nitriet in het milieu . Deze cruciale omzetting is een belangrijke fase in de stikstofcyclus. En het recyclen van stikstof is zeer essentieel omdat de aardatmosfeer ongeveer 85% stikstof bevat . Daarom, wegens zijn belangrijke bijdrage aan het milieu is een andere motivatie voor het rangschikken van het genoom van C. freundii.het geslacht Citrobacter werd in 1932 ontdekt door Werkman en Gillen. Culturen van C. freundii werden in hetzelfde jaar geïsoleerd en geïdentificeerd uit bodemextracten .
Genoomstructuur
geen informatie over het volledige genoom van C. freundii is online beschikbaar, hoewel sommige individuele stammen en plasmiden van de microbe zijn gesequenced. De meest prominente is de plasmide pCTX-M # 3 omdat het de grootste plasmide is en codeert voor een grote hoeveelheid eiwitten. De reeks werd voltooid op 6 januari 2005. Het is een cirkellasmide van DNA en het is 89.468 lange nucleotidebasenparen. De lengte van het plasmide is 0,089468 (Mbp). Het is samengesteld uit 51.0% GC inhoud, en codeert 105 proteã nen .
een ander belangrijk kenmerk van de C. freundii genoom is dat het de enige microbe in de Enterobacteriaceae familie die een plasmide bevat die codeert L-methionine γ-lyase (MGL). De nucleotidesequentie van het plasmide bevat een 3000 BP lange ecori-insert . Het fragment bevat ook twee open leesframes. Het eerste frame bestaat uit 1.194 nucleotiden en het tweede uit 1.296 nucleotiden.Het eerste frame, bekend als het megl-gen, codeert een eiwit van 398 aminozuurresiduen dat sequentiehomologie met MGLs uit verschillende bronnen heeft. Het tweede kader codeert een proteã ne met opeenvolgingshomologie met proteã nen die tot de familie van permeasen behoren .
Het C. freundii OS60 AmpC β-lactamase gen is ook gesequenced en bestaat uit 1197 nucleotiden. Het codeert een 380 aminozuur lange voorloper en bevat een 19 residu signaal peptide in de 5 ‘ einde . Dit gen codeert een volwassen eiwit met een molecuulmassa van 39 781 Dalton. De aminozuurposities in deze precursor zijn identiek aan residu ‘ s in de E. coli K12 chromosomale AmpC β-lactamasen .
een andere belangrijke stam in het genoom van C. freunii is GN346, een klinisch isolaat uit 1965. Deze stam produceert het enzym cefalosporinase, dat de anibitoica cefalosporinen en cefamycinen kan hydrolyseren en inactiveren . De structurele en promotorgebieden van het cefalosporinasegen zijn 1408 lange nucleotiden. De aminozuurvolgorde van het rijpe enzym, bestaat uit 361 aminozuren met een molecuulmassa van 39.878 Da .
celstructuur en metabolisme
de celstructuur van C. freundi is lang en staafvormig, meestal 1-5 µm lang. De buitenkant van de cel bevat veel flagella gebruikt voor motaliteit . Aangezien C. freundii gramnegatieve bacteriën is, bevat het twee membranen (binnen en buiten).De periplasmische ruimte ligt tussen de twee membranen. Het buitenmembraan bevat geen energiebron; maar het bevat vele porinen die binnen worden ingebed die helpen het organisme belangrijke ionen verwerven . In tegenstelling tot gram-positieve bacteriën, bevatten de cellen van C. freundii geen dikke celwand die uit peptidoglycan wordt samengesteld. voor het metabolisme heeft C. freundii een verbazingwekkend vermogen om te groeien op glycerol als enige koolstof-en energiebron. In dit proces wordt glycerol gefermenteerd door een dismutatieproces. Dit proces vereist twee wegen . In de eerste route wordt glycerol gedehydrogeneerd door een nad1-gebonden glyceroldehydrogenase aan dihydroxyaceton. Dihydroxyacetone wordt dan gefosforyleerd en aan glycolyse door dihydroxyacetonekinase geleid . In de tweede weg, wordt glycerol uitgedroogd door het co-enzym B12-afhankelijke glyceroldehydratase om 3-hydroxypropionaldehyde te vormen . Dit product wordt gereduceerd tot het belangrijkste fermentatieproduct 1,3-propaandiol door de nadh-gebonden 1,3-propaandioldehydrogenase, die NAD1 regenereert. Het DHA-regulon codeert voor de vier essentiële enzymen van deze twee routes. Verbazingwekkend genoeg wordt de expressie van de DHA regulon alleen opgewekt als er glycerol aanwezig is .
cellen van C. freundii kunnen ook lactose of citraat als koolstofbron metaboliseren .
ecologie
Citrobacter freundii komen vaak voor in het milieu, voornamelijk in bodem, water en riolering. Ze zijn een indicator van mogelijke verontreiniging van water. Ze worden ook gevonden op verschillende organen van zieke dieren, waaronder zoogdieren, vogels, reptielen en amfibieën . Het is niet bekend dat ze interageren met andere organen.
in het milieu kan C. freundii nitraat of het ammoniumion (een stikstofatoom gecombineerd met vier waterstofatomen) omzetten in nitriet; deze reactie vindt zowel in het milieu als in het spijsverteringskanaal van mensen en andere dieren plaats . Nadat het nitraat in het milieu in nitriet omzet, wordt het nitriet omgezet in stikstof, en deze laatste stap voltooit de stikstofcyclus in de atmosfeer van de aarde, die voor 85% uit stikstof bestaat . De ecologische rol van dit organisme omvat niet alleen zijn belangrijke rol in de stikstofcyclus, omdat het ook uranium (het basismateriaal voor nucleaire technologie) kan accumuleren door fosfaatcomplexen te bouwen .
Citrobacter freundii is ook onderzocht voor de biologische afbraak van looizuur gebruikt in tannerys .
pathologie
als een opportunistisch pathogeen is Citrobacter freundii vaak de oorzaak van significante opportunistische infecties, wat betekent dat het in het algemeen geen ziekte veroorzaakt bij gezonde menselijke gastheren. Ze beïnvloeden alleen patiënten met een zwak immuunsysteem, wat betekent dat ze een “kans” nodig hebben om de persoon te infecteren . Daarom is bij patiënten met een onderdrukt immuunsysteem bekend dat Citrobacter-soorten een grote verscheidenheid aan nosocomiale infecties van de luchtwegen, urinewegen en het bloed veroorzaken . Lever -, gal-en pancreasziekte zijn ook veel voorkomende ziekten die worden veroorzaakt door C. freundii. De galwegen is de meest voorkomende plaats van infectie door de C. freundii bacilli .
een dodelijke ziekte waarmee C. freundii in verband is gebracht, is neonatale meningitis. Neonatale meningitis is de ontsteking van de hersenvliezen (het systeem van membranen die het CNS omringen) als gevolg van bacteriële invasie . Het sterftecijfer van Citrobacter meningitis is onaanvaardbaar hoog, met sterftecijfers van patiënten variërend van 25 tot 50 %. Bovendien blijven bij 75% van de overlevenden ernstige neurologische problemen bestaan. In deze ziekte, Citrobacter freundii is in staat om de bloed-hersenbarrière die bestaat uit het choroid plexus epitheel en de hersenen capillaire endotheel dringen .
Tests uitgevoerd door Badger et. al in het artikel “Citrobacter freundii Invades and Replicates in Human Brain microvasculaire Endothelial Cells”suggereren dat bacteriële proliferatie van C. freundii plaatsvindt op het intracellulaire niveau, die in strijd was met de algemene wetenschappelijke gedachte. De bevindingen wijzen erop dat C. freundii vacuolen doorloopt, repliceert en vrijkomt in de basolaterale zijde van de microvasculaire endotheelcellen van de menselijke hersenen (HBMEC) om de bloed-hersenbarrière te passeren. Verdere analyse kan mogelijk therapeutische strategieën toestaan om infecties te behandelen. Er is nog steeds geen therapeutische behandeling beschikbaar .
bepaalde ziekten die bestudeerd zijn bij forel en karperachtigen worden ook veroorzaakt door C. freundii. C. freundii veroorzaakt abnormale inflammatoire veranderingen in de darm van forel en inflammatoire en necrotische veranderingen in de interne organen van karperachtigen. De ziekte werd ontdekt door middel van kunstmatige infectie met een zuivere cultuur van C. freundii. Deze ontdekking stelde C. freundii vast als een oorzaak van visziekte .
in een casestudy van het Journal of Medical Microbiology ontwikkelde een patiënt peritonitis en tunnelinfectie als gevolg van Citrobacter freundii, wat niet vaak voorkomt. De patiënt kreeg continue ambulante peritoneale dialyse. Meestal zijn de veroorzakers grampositieve micro-organismen, met name Staphylococcus aureus en Staphylococcus edpidermis. Ook zijn er geen meldingen bekend van tunnelinfectie door C. freundii. De eerste behandeling met antibiotica werkte niet en de infectie bleef aanhouden totdat de katheter werd verwijderd. Dit is klinisch significant omdat Citrobacter Freundii verschillende gevoeligheid voor antibiotica vertoont, wat de reden is waarom de initiële therapie niet succesvol was. De patiënt reageerde niet op de behandeling totdat de katheter werd verwijderd, waaruit blijkt dat Citrobacter freundii opportunistische pathogenen zijn die gehospitaliseerde en immuungecompromitteerde patiënten beïnvloeden .
toepassing op biotechnologie
in de Biotechindustrie produceert Citrobacter freundii vele belangrijke enzymen.De eerste enzymen die het produceert is fosfatase. Fosfatase activiteit van C. freundii wordt verondersteld betrokken te zijn bij loodaccumulatie, die een belangrijke rol kan hebben gespeeld in de Biotech-industrie. De fosfataseactiviteit van C. freundii is ook ontdekt om weerstand tegen sommige kenmerkende reagentia te hebben .
de zuivering en karakterisering van bacterieel selenocysteïne beta-lyase, een enzym dat specifiek de splitsing van L-selenocysteïne tot L-alanine katalyseert, is gezuiverd uit Citrobacter freundii. Het enzym is monomeer met een molecuulgewicht van ca. 64.000 en bevat 1 mol pyridoxal 5 ‘ – fosfaat als cofactor per mol enzym. Het enzym katalyseert ook de Alfa, bètaverwijdering van bèta-chloor-L-alanine om NH3, pyruvaat te vormen .
C. freundii stammen hebben ook een plasmide dat codeert voor klasse 1 AmpC cefalosporinase. Deze enzymen kunnen hydrolzye nieuwe cefamycinen en cefalosporinen inactiveren .
huidig onderzoek
een kleinschalig onderzoek met betrekking tot bepaalde stammen van C. freundii werd onlangs gedaan aan de Universiteit van Tennessee, Knoxville. Het belang van bepaalde tetracycline-en streptomycine-resistentiegenen en klasse 1-integronen in C. freundii geïsoleerd uit melkboerderij bodem en niet-droge bodems werden geëvalueerd. Eén stam van C. freundii, geëxtraheerd uit melkboerderijen, bevatte klasse 1-integronen met verschillende ingebrachte gencassettes. De resultaten van deze kleine studie suggereren dat de aanwezigheid van meerdere resistentiegenen en klasse 1 integronen in C. freundii in melkveehoudergrond kan fungeren als een reservoir van antimicrobiële resistentiegenen en een rol kan spelen in de verspreiding van deze antimicrobiële resistentiegenen naar andere commensale en inheemse microbiële gemeenschappen in de bodem. Echter, extra lange termijn studies uitgevoerd op meer locaties nodig zijn om deze hypothese te ondersteunen .
een tweede onderzoek met betrekking tot C. freundii werd gedaan om een polymerasekettingreactie (PCR) methode te ontwikkelen die gelijktijdig drie paren specifieke primers gebruikt om genen van bepaalde microben (waaronder C. freundii) te detecteren. De methode omvatte het ontwerpen van drie primerparen die waren: SPVC-1 en SPVC-2, INVA-1 en INVA-2; en VIAB-1 en VIAB-2. PCR werd uitgevoerd gebruikend deze drie inleidingen om 14 klinisch belangrijke bacteriële organismen te identificeren. De volgende stammen werden snel geïdentificeerd met behulp van de PCR: (1) C. freundii; (2) S. Typhi; en S. Paratyphi C; (3) S. Dublin (virulentie-antigeen-positief); en (4) Salmonella serovars die een SPV-type virulentie plasmide bevatten. Hoewel deze PCR methode nieuw is, met de vooruitgang van technologie in de toekomst kan deze methode de identificatie van C. freundii in zoogdieren onmiddellijk toestaan zodat de aangewezen antibiotische behandeling zonder vertraging kan worden gestart .een derde studie betreffende C. freundii werd verricht aan de Universiteit van Barcelona, Spanje. De resistentiemechanismen tegen fluoroquinolonen in twee Citrobacter freundii stammen werden bestudeerd. Beide stammen werden geïsoleerd van dezelfde patiënt. Deze studie maakte een gedeeltelijke karakterisering van de acrA-en acrB-genen van dit micro-organisme mogelijk. Expressie van genen in beide stammen werd geanalyseerd met behulp van DNA microarrays voor Escherichia coli. De Nucleotide-overeenkomst tussen de gedeeltelijk gesequenced acrA-en acrB-genen van C. freundii en E. coli was respectievelijk 80,7% en 85%. De acrA-en acrB-genen van C. freundii zijn vergelijkbaar met die van E. coli en hun overexpressie kunnen een belangrijke rol spelen bij het moduleren van de uiteindelijke minimale remmende concentratie van fluorochinolonen .een vierde studie met betrekking tot C. freundii werd uitgevoerd in Taiwan. Een team van onderzoekers isoleerde een diabetespatiënt die necrotiserende fasciitis ontwikkelde die door C. freundii werd veroorzaakt van een verwonding die door een zeedier werd aangezet. Necrotiserende fasciitis is een infectie binnen de diepere laag van de huid en subcutane weefsels. Bij de behandeling van de patiënt namen ze een monster van de vloeistof in de wond en vonden C. freundii. Na drie dagen na aanvang van de antibioticabehandeling met cefotaxmine en cefepmine, was er accumulatie van subcutane abcessen. Na 6, 10, 14 en 21 dagen verzorging van de patiënt, gaven sommige antibiotica de patiënt enige verlichting, maar op lange termijn werd geen herstel bereikt. Cefotoaxime, cefepime, ciprofloxamin behoren tot de antibiotica die geen gelijke Voor C. freundii waren. De patiënt herstelde volledig na 42 dagen behandeling met ertapenem. De onderzoekers hadden twee kolonies van C. freundii geïsoleerd binnen 5 dagen na elkaar. Naarmate de isolaten werden gekweekt werden ze immens resistent tegen cefotaxime en cefepime. De reden waarom entrapenem tegen C. freundii werkte is omdat het actief is tegen AmpC producerende Enterobacteriaceae .
antibioticaresistentie
Citrobacter-soorten zijn een veel voorkomende oorzaak van nosocomiale infecties bij patiënten die langdurige ziekenhuisbehandelingen ondergaan. Van C. freundii is onlangs gemeld dat het resistentie tegen breedspectrum antibiotincs uitdrukt, waaronder piperacilline, piperacillintazobactam, vancomycine en cefalosporines. Isolatie van ceftriaxon-resistente Citrobacter freundii (CRCF) is geassocieerd met de overschreven breedspectrumantibiotica. De opkomende nieuwe crcf-stammen kunnen inductie of depressie van resistentiegenen en eliminatie van concurrerende organismen suggereren. CRCF is meestal geïsoleerd van patiënten met significante comorbiditeiten, waaronder AIDS, perifere vasculaire aandoeningen en cerebrovasculaire aandoeningen. Het gebruik van fluoroquinolone is ook gemeld om geen invloed tegen de isolatie van CRCF te hebben .het is ook bekend dat Citrobacter freundii in zijn chromosoom een gen bevat dat codeert voor cefalosporinase. Dit enzym hydrolyseert-CO-NH-binding in de lactamring van cefalosporinen en cefamycis waardoor de bacteriën resistent worden tegen dit type antibiotica. Bij blootstelling aan nieuwe cefemen en cerbapenems van de derde generatie vertoonde de klinisch geïsoleerde C. freundii echter gevoeligheid voor deze stoffen.Een kleine uitbraak van C. freundii resistent tegen cefems van de derde generatie is waargenomen in de chirurgische afdeling van Nagoya University Hospital bij patiënten die chirurgische ingrepen ondergingen. De C. freundii werd geïsoleerd van de gal van de patiënt, wondgaas, uitwerpselen, pus en ascites. Er werd gesuggereerd dat deze nieuwe stammen van C. freundii een plasmide bevatten die AmpC celphalosporinase codeert, maar bij het niet overdragen van de cefems resistentie van C. freundii naar E. coli werd geconcludeerd dat het enzym moet worden gecodeerd in het chromosoom van C. freundii. Aangezien C. freundi wordt geassocieerd met nosocomiale infecties wordt voorzichtigheid aanbevolen voor deze nieuwe stammen .
1. Wang JT, Chang SC, Chen YC, Luh KT. “Comparison of antimicrobial susceptibility of Citrobacter freundii isolates in two different time periods.”The Journal of Microbiology, Immunology and Infection. 2000 Dec; 33 (4): 258-62.
2. Whalen JG, Mully TW, Enlgish JC 3rd. “Spontane Citrobacter freundii infectie in een immunocompetente patiënt.”Archives of dermatology. 2007 Jan; 143 (1): 124-5.
3. Puchenkova SG. “Enterobacteria in de gebieden van het water langs Krymskogo kust.”Mikrobiolohichny ZH zhurnal. 1996 Mrt-Apr; 58 (2): 3-7.
4.http://www.ncbi.nlm.nih.gov/sites/entrez?db=genomeprj&cmd=Retrieve&dopt=Overview&list_uids=13123
5. Ilya V. Manukhov, Daria V. Mamaeva, Sergei M. Rastorguev, Nicolai G. Faleev, Elena A. Morozova, Tatjana V. Demidkina, en Gennadii B. Zavilgelsky. “Een gen dat codeert voor L-Methionine γ-Lyase is aanwezig in Enterobacteriaceae familie genomen: identificatie en karakterisering van Citrobacter freundii L-Methionine γ-Lyase.”The Journal of Bacteriology. 2005 juni; 187 (11): 3889-3893.
6. Lindberg, Frederik; Westman, Lennart; Normark, Staffan. “Regulatory Components in Citrobacter freundii ampC β-lactamase Induction.”Proceedings of the National Academy of Sciences of the United States of America. 1985 juli; 82 (14): 4620-4624.
7. Tsukamoto K, Tachibana K, Yamazaki N, Ishii Y, Ujiie K, Nishida N, Sawai T. ” Role of lysine-67 in the active site of class C beta-lactamase from Citrobacter freundii GN346.”European Journal of Biochemistry / FEBS. 1990 Feb 22; 188 (1): 15-22.
8. Keevil CW, Hough JS, Cole JA. “Prototrophic growth of Citrobacter freundii and the biochemical basis for its schijnbare growth requirements in aerated media.”Journal of General Microbiology. 1997 Jan; 98 (1): 273-6.
9. Marco Sánchez F, Turabian Fernández JL, Durán Pérez-Navarro A. “Fatale Citrobacter Freundii bronchopneumonie verworven in de Gemeenschap bij een compromisloze patiënt.”Revista Clínica Española. April 1985; 176 (6): 320
10. Julie L. Badger, Monique F. Stins en Kwang sik Kim. “Citrobacter freundii valt binnen en repliceert in menselijke hersenen microvasculaire endotheelcellen.Hinyokika kiyo. Acta Urologica Japonica. 1985 juli; 31 (7): 1159-70.
11. Drelichman V, Band JD. “Bacteremias due to Citrobacter diversus and Citrobacter freundii. Incidentie, risicofactoren en klinische uitkomst.”Archives of Internal Medicine. 1985 okt; 145( 10): 1808-10.
12. Srinivasan V, Nam HM, Sawant AA, Headrick SI, Nguyen LT, Oliver SP. “Distribution of tetracycline and streptomycine Resistance Genes and Class 1 Integrons in Enterobacteriaceae Isolated from Dairy and Nondairy Farmsoil.”Microbial Ecology. 2007 Aug 15.
13. Sánchez-Céspedes J, Vila J. “Partial characterisation of the acrAB locus in two Citrobacter freundii clinical isolates.”International Journal of Antimicrobial Agents. 2007 Sep; 30 (3): 259-63.
14. Ciğerci IH, Korcan SE, Konuk M, Oztürk S. “Comparison of ALAD activities of Citrobacter and Pseudomonas stammen and their usage as biomarker for Pb contamination.”Environmental Monitoring and Assessment. 2007 22 mei.
15. Chocat P, Esaki N, Tanizawa K, Nakamura K, Tanaka H, Soda K. ” zuivering en karakterisering van selenocysteine beta-lyase uit Citrobacter freundii.”Journal of Bacteriology. 1985 Aug; 163( 2): 669-76.
16. Hillel S Levinson, Inga Mahler. “Phosphatase activiteit en lood resistentie in Citrobacter freundii en Staphylococcus aureus.”Fems Microbiology Letters. 1998 Apr; 161( 1): 135-138.
17. Murakami K, Yoshida T. ” covalente binding van moxalactam aan cephalosporinase van Citrobacter freundii.”Antimicrobial Agents and Chemotherapy. 1985 mei; 27 (5): 727-32.
18. Dervisoglu, E., Yegenaga, I., Yumuk, Z. ” Citrobacter Freundii peritonitis and tunnel infection in a patient on continuous ambulatory peritoneal dialysis.”Journal of Medical Microbiology, 2008. Deel 57. p. 125-127.
19. Kim PW, Harris AD, Roghmann MC, Morris JG Jr, Strinivasan A, Perencevich EN. “Epidemiological risk factors for isolation of ceftriaxone-resistant versus-sensible citrobacter freundii in hospitalized patients” Antimicrob Agents Chemother, 2003 Sep;47 (9): p.2882-2887.
20. Nada T, Baba H, Kawamura K, Ohkura T, Torii K, Ohta M. “Een kleine uitbraak van de derde generatie cephem-resistente Citrobacter freundii infectie op een chirurgische afdeling” Jpn J infecteren Dis. 2004 Aug; 57 (4): p. 181-182.
21. Chuang, Y., Tseng, S., Teng, L., Ho, Y., en Hsueh, P. “Emergence of cefotaxime resistance in Citrobactor freundii causing necrotizing fasciitis and osteomyelitis” Journal of Infection, 2006. Deel 53. e161-e163.
22.Badger, J., Stins, M., and sik Kim, K. “Citrobacter freundii Invades and Replices in Human Brain microvasculaire Endothelial Cells” Infection and Immunity, 1999. Volume67. P. 4208-4215.uitgegeven door Sumaira Akbarzada, student van Rachel Larsenuitgeschreven door Greg Vargas en Darren Zhen, studenten van de M Glogowskiat Loyola Universityuitgeschreven door Gergana Grigorova en Michal Olszewski, studenten van de M Glogowskiat Loyola Universityuitgeschreven door Alex Kula en Joanna Aiken, studenten van de M Glogowskiat Loyola University