A Microbial Biorealm page on the genus Citrobacter freundii
Classification
Higher order taxa
Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Citrobacter
Species
NCBI: Taxonomy
Citrobacter Freundii
Description and significance
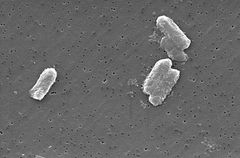 Photo: Pete Wardell / CDC
Photo: Pete Wardell / CDC
Les espèces Citrobacter, y compris Citrobacter freundii, sont des bacilles à gram négatif aérobies. Les Citrobacter freundii sont de longues bactéries en forme de bâtonnets de 1 à 5 µm de longueur. La plupart des cellules de C. freundii sont entourées de nombreux flagelles utilisés pour se déplacer, mais quelques-uns sont non mobiles. Son habitat comprend l’environnement (sol, eau, eaux usées), la nourriture et les voies intestinales des animaux et des humains. Il appartient à la famille des entérobactéries.
En tant qu’agent pathogène opportuniste, C. freundii est responsable d’un certain nombre d’infections opportunistes importantes. Il est connu pour être la cause d’une variété d’infections nosocomiales des voies respiratoires, des voies urinaires, du sang et de plusieurs autres sites normalement stériles chez les patients. C. freundii représente environ 29% de toutes les infections opportunistes. Par conséquent, l’une des principales raisons pour lesquelles de nombreuses souches et plasmides différents du génome de C. freundii sont séquencés est de trouver des antibiotiques capables de combattre ces infections opportunistes.
Étonnamment, ce microbe infectieux chez l’homme joue un rôle positif dans l’environnement. C. freundii est responsable de la réduction des nitrates en nitrites dans l’environnement. Cette conversion cruciale est une étape importante du cycle de l’azote. Et le recyclage de l’azote est très essentiel car l’atmosphère terrestre contient environ 85% d’azote. Par conséquent, en raison de sa contribution importante à l’environnement est une autre motivation pour le séquençage du génome de C. freundii.
Le genre Citrobacter a été découvert en 1932 par Werkman et Gillen. Des cultures de C. freundii ont été isolées et identifiées la même année à partir d’extraits de sol.
Structure du génome
Aucune information sur le génome complet de C. freundii n’est disponible en ligne, bien que certaines souches individuelles et certains plasmides du microbe aient été séquencés. Le plus important est le plasmide pCTX-M # 3 car c’est le plus gros plasmide et code une grande quantité de protéines. Sa séquence s’est terminée le 6 janvier 2005. C’est un plasmide d’ADN circulaire et il mesure 89 468 paires de bases nucléotidiques. La longueur du plasmide est de 0,089468 (Mbp). Il est composé de 51,0% de teneur en GC et code 105 protéines.
Une autre caractéristique importante du C. le génome de freundii est qu’il s’agit du seul microbe de la famille des Enterobacteriaceae qui contient un plasmide codant pour la L-méthionine γ-lyase (MGL). La séquence nucléotidique du plasmide contient un insert EcoRI de 3000 pb de long. Le fragment contient également deux cadres de lecture ouverts. La première trame comprend 1 194 nucléotides et la seconde, 1 296 nucléotides.La première trame, connue sous le nom de gène megL, code pour une protéine de 398 résidus d’acides aminés qui présente une homologie de séquence avec les MGL de différentes sources. La deuxième trame code pour une protéine à homologie de séquence avec des protéines appartenant à la famille des perméases.
Le gène β-lactamase de C. freundii OS60 AMPc a également été séquencé et il est composé de 1197 nucléotides. Il code pour un précurseur long de 380 acides aminés et contient un peptide signal résiduel 19 à l’extrémité 5’. Ce gène code pour une protéine mature qui a une masse moléculaire de 39 781 Daltons. Les positions des acides aminés dans ces précurseurs sont suprêmement identiques aux résidus dans les β-lactamases des AMPc chromosomiques K12 d’E. coli.
Une autre souche importante dans le génome de C. freunii est GN346, qui est un isolat clinique récupéré en 1965. Cette souche produit l’enzyme céphalosporinase, qui a la capacité d’hydrolyser et d’inactiver les céphalosporines anibitoïques et les céphamycines. Les régions structurales et promotrices du gène de la céphalosporinase mesurent 1408 nucléotides. La séquence d’acides aminés de l’enzyme mature est composée de 361 acides aminés d’une masse moléculaire de 39 878 Da.
Structure cellulaire et métabolisme
La structure cellulaire de C. freundi est longue et en forme de bâtonnet, généralement de 1 à 5 µm de longueur. L’extérieur de la cellule contient de nombreux flagelles utilisés pour la motalité. Comme C. freundii est une bactérie à gram négatif, il contient deux membranes (interne et externe).L’espace périplasmique se situe entre les deux membranes. La membrane externe ne contient pas de source d’énergie; mais elle contient de nombreuses porines intégrées qui aident l’organisme à acquérir des ions importants. Contrairement aux bactéries à gram positif, les cellules de C. freundii ne contiennent pas de paroi cellulaire épaisse composée de peptidoglycane.
Pour le métabolisme, C. freundii a une capacité étonnante à se développer sur le glycérol comme seule source de carbone et d’énergie. Dans ce processus, le glycérol est fermenté par un processus de dismutation. Ce processus nécessite deux voies. Dans la première voie, le glycérol est déshydrogéné par une glycérol déshydrogénase liée au NAD1 en dihydroxyacétone. La dihydroxyacétone est ensuite phosphorylée et acheminée vers la glycolyse par la dihydroxyacétone kinase. Dans la deuxième voie, le glycérol est déshydraté par la glycérol déshydratase dépendante de la coenzyme B12 pour former du 3-hydroxypropionaldéhyde. Ce produit est réduit au 1,3-propanediol principal de la fermentation par la 1,3-propanediol déshydrogénase liée au NADH, qui régénère le NAD1. Le régulateur dha code les quatre enzymes essentielles de ces deux voies. Étonnamment, l’expression du régulateur dha n’est induite que lorsque du glycérol est présent.
Les cellules de C. freundii sont également capables de métaboliser le lactose ou le citrate comme source de carbone.
Écologie
Les Citrobacter freundii sont couramment présents dans l’environnement, principalement dans le sol, l’eau et les égouts. Ils sont un indicateur de contamination potentielle de l’eau. On les trouve également sur différents organes d’animaux malades, notamment des mammifères, des oiseaux, des reptiles et des amphibiens. Ils ne sont pas connus pour interagir avec d’autres organes.
Dans l’environnement, C. freundii peut convertir le nitrate ou l’ion ammonium (qui est un atome d’azote combiné à quatre atomes d’hydrogène) en nitrite; cette réaction se produit dans l’environnement ainsi que dans le tube digestif des humains et d’autres animaux. Après avoir converti le nitrate en nitrite dans l’environnement, le nitrite est converti en azote, et cette dernière étape complète le cycle de l’azote dans l’atmosphère terrestre, qui est composée de 85% d’azote. Le rôle écologique de cet organisme ne comprend pas seulement son rôle important dans le cycle de l’azote, car il peut également accumuler de l’uranium (qui est la matière de base de la technologie nucléaire) en construisant des complexes phosphatés.
Citrobacter freundii a également été étudié pour la biodégradation de l’acide tannique utilisé dans les tanneries.
Pathologie
En tant qu’agent pathogène opportuniste, Citrobacter freundii est souvent la cause d’infections opportunistes importantes, ce qui signifie qu’il ne cause généralement pas de maladie chez des hôtes humains en bonne santé. Ils n’affectent que les patients dont le système immunitaire est faible, ce qui signifie qu’ils ont besoin d’une « opportunité » d’infecter la personne. Par conséquent, chez les patients dont le système immunitaire est supprimé, les espèces de Citrobacter sont connues pour provoquer une grande variété d’infections nosocomiales des voies respiratoires, des voies urinaires et du sang. Les maladies hépatiques, biliaires et pancréatiques sont également des maladies courantes causées par C. freundii. Les voies biliaires sont le site d’infection le plus fréquent par les bacilles de C. freundii.
Une maladie mortelle à laquelle C. freundii a été associée est la méningite néonatale. La méningite néonatale est l’inflammation des méninges (le système de membranes qui entourent le SNC) due à une invasion bactérienne. Le taux de mortalité de la méningite Citrobacter est inacceptable, avec des taux de mortalité de patients allant de 25 à 50%. De plus, de graves problèmes neurologiques persistent encore chez 75% des survivants. Dans cette maladie, Citrobacter freundii est capable de pénétrer la barrière hémato-encéphalique constituée de l’épithélium du plexus choroïde et de l’endothélium capillaire cérébral.
Tests effectués par Badger et. al dans l’article « Citrobacter freundii Envahit et se réplique dans les Cellules Endothéliales Microvasculaires du Cerveau Humain” suggère que la prolifération bactérienne de C. freundii a lieu au niveau intracellulaire, ce qui était contraire à la pensée scientifique générale. Les résultats indiquent que C. freundii traverse des vacuoles, se réplique et est libéré dans la face basolatérale des cellules endothéliales microvasculaires du cerveau humain (HBMEC) afin de traverser la barrière hémato-encéphalique. Une analyse plus approfondie peut potentiellement permettre des stratégies thérapeutiques pour traiter les infections. Il n’y a toujours pas de traitement thérapeutique disponible.
Certaines maladies étudiées chez la truite et les cyprinidés sont également causées par C. freundii. C. freundii provoque des changements inflammatoires anormaux dans l’intestin de la truite et des changements inflammatoires et nécrotiques dans les organes internes des cyprinidés. La maladie a été découverte au moyen d’une infection artificielle avec une culture pure de C. freundii. Cette découverte a établi C. freundii comme une cause de maladie des poissons.
Dans une étude de cas réalisée par le Journal of Medical Microbiology, un patient a développé une péritonite et une infection tunnel due à Citrobacter freundii, ce qui est rare. Le patient était sous dialyse péritonéale ambulatoire continue. Habituellement, les agents responsables sont des micro-organismes à gram positif, en particulier Staphylococcus aureus et Staphyloccus edpidermis. De plus, il n’y a aucun rapport connu d’infection par le tunnel due à C. freundii. L’antibiothérapie initiale n’a pas fonctionné et l’infection a continué de persister jusqu’à ce que le cathéter soit retiré. Ceci est cliniquement significatif car Citrobacter Freundii présente une sensibilité aux antibiotiques différente, ce qui explique pourquoi le traitement initial n’a pas réussi. Le patient n’a pas répondu au traitement jusqu’à ce que le cathéter ait été retiré, montrant que les Citrobacter freundii sont des agents pathogènes opportunistes qui affectent les patients hospitalisés et immunodéprimés.
Application à la biotechnologie
Dans l’industrie de la biotechnologie, Citrobacter freundii produit de nombreuses enzymes importantes.Les premières enzymes qu’il produit sont la phosphatase. Activité phosphatase de C. freundii a été supposé être impliqué dans l’accumulation de plomb, qui peut avoir joué un rôle important dans l’industrie de la biotechnologie. Il a également été découvert que l’activité phosphatase de C. freundii présente une résistance à certains réactifs de diagnostic.
La purification et la caractérisation de la sélénocystéine bêta-lyase bactérienne, une enzyme qui catalyse spécifiquement le clivage de la L-sélénocystéine en L-alanine, ont été purifiées à partir de Citrobacter freundii. L’enzyme est monomère avec un poids moléculaire de ca. 64 000 et contient 1 mole de pyridoxal 5′-phosphate comme cofacteur par mole d’enzyme. L’enzyme catalyse également l’élimination alpha et bêta de la bêta-chloro-L-alanine pour former du NH3, pyruvate.
Les souches de C. Freundii portent également un plasmide codant pour la céphalosporinase AMPc de classe 1. Ces enzymes peuvent hydrolzye inactiver de nouvelles céphamycines et céphalosporines.
Recherche actuelle
Une recherche à petite échelle concernant certaines souches de C. freundii a été effectuée récemment à l’Université du Tennessee, Knoxville. L’importance de certains gènes de résistance à la tétracycline et à la streptomycine et des intégrons de classe 1 dans C. les freundii isolés du sol de ferme laitière et des sols non laitiers ont été évalués. Une souche de C. freundii extraite de sols de fermes laitières portait des intégrons de classe 1 avec différentes cassettes de gènes insérées. Les résultats de cette petite étude suggèrent que la présence de gènes de résistance multiples et d’intégrons de classe 1 chez C. freundii dans le sol d’une ferme laitière pourrait agir comme un réservoir de gènes de résistance aux antimicrobiens et pourrait jouer un rôle dans la dissémination de ces gènes de résistance aux antimicrobiens à d’autres communautés microbiennes commensales et indigènes dans le sol. Cependant, d’autres études à plus long terme menées dans un plus grand nombre d’endroits sont nécessaires pour étayer cette hypothèse.
Une deuxième recherche portant sur C. freundii a été effectuée afin de concevoir une méthode de réaction en chaîne par polymérase (PCR) qui utilise simultanément trois paires d’amorces spécifiques pour détecter les gènes de certains microbes (dont C. freundii). La méthode comprenait la conception de trois paires d’amorces qui étaient: SPVC-1 et SPVC-2, INVA-1 et INVA-2; et VIAB-1 et VIAB-2. La PCR a été réalisée à l’aide de ces trois amorces pour identifier 14 organismes bactériens cliniquement importants. Les souches suivantes ont été rapidement identifiées à l’aide de la PCR : (1) C. freundii; (2) S. Typhi; et S. Paratyphi C; (3) S. Dublin (antigène de virulence positif); et (4) sérovars de Salmonella qui abritent un plasmide de virulence de type spv. Bien que cette méthode de PCR soit nouvelle, avec les progrès de la technologie à l’avenir, cette méthode peut permettre l’identification immédiate de C. freundii chez les mammifères afin que le traitement antibiotique approprié puisse être initié sans délai.
Une troisième étude portant sur C.freundii a été réalisée à l’Université de Barcelone, en Espagne. Les mécanismes de résistance aux fluoroquinolones chez deux souches de Citrobacter freundii ont été étudiés. Les deux souches ont été isolées chez le même patient. Cette étude a permis de caractériser partiellement les gènes acrA et acrB de ce microorganisme. L’expression des gènes dans les deux souches a été analysée à l’aide de puces à ADN pour Escherichia coli. La similitude nucléotidique entre les gènes acrA et acrB partiellement séquencés de C. freundii et d’E. coli était de 80,7 % et 85 %, respectivement. Les gènes acrA et acrB de C. freundii sont similaires à ceux de E. coli et leur surexpression peuvent jouer un rôle important dans la modulation de la concentration inhibitrice minimale finale des fluoroquinolones.
Une quatrième étude concernant C. freundii a été réalisée à Taiwan. Une équipe de chercheurs a isolé un patient diabétique qui a développé une fasciite nécrosante causée par C. freundii à partir d’une blessure provoquée par un animal marin. La fasciite nécrosante est une infection dans la couche plus profonde de la peau et des tissus sous-cutanés. Lors du traitement du patient, ils ont prélevé un échantillon du liquide contenu dans la plaie et ont trouvé C. freundii. Après trois jours de début des traitements antibiotiques par la céfotaxmine et la céfépmine, il y a eu accumulation d’abcès sous-cutanés. Après 6, 10, 14 et 21 jours de prise en charge du patient, certains antibiotiques soulageaient le patient, mais aucun rétablissement à long terme n’était atteint. Le céfotoaxime, le céfépime et la ciprofloxamine font partie des antibiotiques qui ne correspondaient pas à C. freundii. Le patient s’est complètement rétabli après 42 jours de traitement par ertapénème. Les chercheurs avaient isolé deux colonies de C. freundii à moins de 5 jours l’une de l’autre. Au fur et à mesure que les isolats étaient cultivés, ils sont devenus extrêmement résistants au céfotaxime et au céfépime. La raison pour laquelle le piégenem a travaillé contre C. freundii est parce qu’il est actif contre les AMPc produisant des entérobactéries.
Résistance aux antibiotiques
Les espèces Citrobacter sont une cause fréquente d’infections nosocomiales associées aux patients qui suivent des traitements hospitaliers prolongés. Il a été récemment rapporté que C. freundii exprime une résistance aux antibiotiques à large spectre, notamment la pipéracilline, le pipéracillintazobactam, la vancomycine et les céphalosporines. L’isolement de Citrobacter freundii résistant à la ceftriaxone (CRCF) a été associé aux antibiotiques à large spectre surprescrits. Les nouvelles souches CRCF émergentes pourraient suggérer l’induction ou la dépression de gènes de résistance ainsi que l’élimination d’organismes concurrents. Le CRCF a été principalement isolé chez des patients présentant des comorbidités importantes, notamment le SIDA, les maladies vasculaires périphériques et les maladies cérébrovasculaires. Il a également été rapporté que l’utilisation de la fluoroquinolone n’avait aucun effet sur l’isolement du CRCF.
Citrobacter freundii est également connu pour contenir dans son chromosome un gène codant pour la céphalosporinase. Cette enzyme hydrolyse la liaison CO-NH dans le cycle lactame des céphalosporines et des céphamycis, rendant ainsi les bactéries résistantes à ce type d’antibiotiques. Cependant, lorsqu’il a été exposé à de nouveaux céphèmes et cerbapénèmes de troisième génération, C.freundii, isolé cliniquement, a montré une sensibilité à ces substances.Une petite épidémie de C.freundii résistant aux céphalées de troisième génération a été observée dans le service de chirurgie de l’Hôpital universitaire de Nagoya chez des patients ayant subi des interventions chirurgicales. Le C.freundii a été isolé de la bile du patient, de la gaze de la plaie, des excréments, du pus et de l’ascite. Il a été suggéré que ces nouvelles souches de C. freundii contenaient un plasmide codant pour la celphalosporinase AMPc, mais en cas d’échec du transfert de la résistance aux céphèmes de C. freundii à E. coli, il a été conclu que l’enzyme devait être codée dans le chromosome de C. freundii. Étant donné que C. freundi est associé à des infections nosocomiales, il est recommandé de faire attention à ces nouvelles souches.
1. Wang JT, Chang SC, Chen YC, Luh KT. « Comparaison de la sensibilité aux antimicrobiens des isolats de Citrobacter freundii dans deux périodes différentes. »Le Journal de Microbiologie, d’immunologie et d’infection. 2000 Déc; 33(4): 258-62.
2. Whalen JG, Mully TW, Enlgish JC 3e. « Infection spontanée de Citrobacter freundii chez un patient immunocompétent. » Archives de dermatologie. 2007 Jan; 143(1): 124-5.
3. Puchenkova SG. « Entérobactéries dans les zones d’eau le long de la côte de Crimée. »Mikrobiolohichny zh zhurnal. 1996 Mars-avril; 58(2): 3-7.
4.http://www.ncbi.nlm.nih.gov/sites/entrez?db=genomeprj&cmd=Retrieve&dopt=Overview&list_uids=13123
5. Ilya V. Manukhov, Daria V. Mamaeva, Sergei M. Rastorguev, Nicolai G. Faleev, Elena A. Morozova, Tatiana V. Demidkina et Gennadii B. Zavilgelsky. « Un Gène Codant Pour la L-Méthionine γ-Lyase Est Présent dans les Génomes de la Famille des Enterobacteriaceae: Identification et Caractérisation de la Citrobacter freundii L-Méthionine γ-Lyase. »Le Journal de bactériologie. 2005 Juin; 187 (11): 3889-3893.
6. Lindberg, Frederik; Westman, Lennart; Normark, Staffan. « Regulatory Components in Citrobacter freundii AMPc β-lactamase Induction. » Proceedings of the National Academy of Sciences of the United States of America. 1985 Juillet; 82 (14): 4620-4624.
7. Tsukamoto K, Tachibana K, Yamazaki N, Ishii Y, Ujiie K, Nishida N, Sawai T. « Rôle de la lysine-67 dans le site actif de la bêta-lactamase de classe C de Citrobacter freundii GN346. » Revue européenne de biochimie / SEBS. 22 février 1990; 188(1): 15-22.
8. Keevil CW, Hough JS, Cole JA. « Croissance prototrophe de Citrobacter freundii et base biochimique de ses besoins de croissance apparents en milieu aéré. »Journal de microbiologie générale. 1997 Jan; 98(1):273-6.
9. Marco Sánchez F, Turabian Fernández JL, Durán Pérez-Navarro A. « Bronchopneumonie Mortelle Citrobacter Freundii Acquise dans la Communauté chez un Patient sans Compromis. » Revista Clínica Española. 1985 Avril; 176(6): 320
10. Julie L. Badger, Monique F. Stins et Kwang Sik Kim. « Citrobacter freundii Envahit et se réplique dans les Cellules Endothéliales Microvasculaires du Cerveau Humain. » Hinyokika kiyo. Acta Urologica Japonica. 1985 Juil; 31(7): 1159-70.
11. Drelichman V, Groupe JD. « Bactériémies dues à Citrobacter diversus et Citrobacter freundii. Incidence, facteurs de risque et résultats cliniques. »Archives de médecine interne. 1985 Oct; 145(10): 1808-10.
12. Srinivasan V, Nam HM, Sawant AA, Headrick SI, Nguyen LT, Oliver SP. « Distribution of Tetracycline and Streptomycin Resistance Genes and Class 1 Integrons in Enterobacteriaceae Isolated from Dairy and Nondairy Farm Soil. »Écologie microbienne. 15 août 2007.
13. Sánchez-Céspedes J, Vila J. « Caractérisation partielle du locus acrAB dans deux isolats cliniques Citrobacter freundii. »Journal International des Agents Antimicrobiens. 2007 Sep; 30(3): 259-63.
14. Ciğerci IH, Korcan SE, Konuk M, Oztürk S. « Comparaison des activités ALAD des souches Citrobacter et Pseudomonas et de leur utilisation comme biomarqueur pour la contamination par le Pb. »Surveillance et évaluation environnementales. 22 mai 2007.
15. Chocat P, Esaki N, Tanizawa K, Nakamura K, Tanaka H, Soda K. « Purification et caractérisation de la sélénocystéine bêta-lyase de Citrobacter freundii. »Journal de bactériologie. 1985 Août; 163(2): 669-76.
16. Hillel S Levinson, Inga Mahler. « Activité de la phosphatase et résistance au plomb chez Citrobacter freundii et Staphylococcus aureus. »Lettres de microbiologie FEMS. 1998 Avril; 161(1): 135-138.
17. Murakami K, Yoshida T. » Liaison covalente du moxalactame à la céphalosporinase de Citrobacter freundii. »Agents antimicrobiens et chimiothérapie. 1985 Mai; 27(5): 727-32.
18. Dervisoglu, E., Yegenaga, I., Yumuk, Z. « Péritonite Citrobacter Freundii et infection tunnel chez un patient sous dialyse péritonéale ambulatoire continue. »Journal de microbiologie médicale, 2008. Volume 57. p. 125 à 127.
19. Kim PW, Harris AD, Roghmann MC, Morris JG Jr, Strinivasan A, Perencevich EN. « Facteurs de risque épidémiologiques d’isolement de citrobacter freundii résistant à la ceftriaxone par rapport à ceux sensibles chez les patients hospitalisés » Antimicrob Agents Chemother, 2003 Sep; 47 (9): p. 2882-2887.
20. Nada T, Baba H, Kawamura K, Ohkura T, Torii K, Ohta M. « Une petite épidémie d’infection Citrobacter freundii de troisième génération résistante aux céphalées dans un service chirurgical » Jpn J Infect Dis. 2004 Août; 57 (4): p. 181-182.
21. Chuang, Y., Tseng, S., Teng, L., Ho, Y. et Hsueh, P. « Emergence of cefotaxime resistance in Citrobactor freundii causing necrotizing fasciitis and osteomyelitis » Journal of Infection, 2006. Volume 53. p. e161-e163.
22.Badger, J., Stins, M. et Sik Kim, K. « Citrobacter freundii Envahit et se réplique dans les Cellules Endothéliales Microvasculaires du Cerveau Humain » Infection et Immunité, 1999. Volume67. P. 4208 à 4215.
Édité par Sumaira Akbarzada, étudiante de Rachel Larsenédité par Greg Vargas et Darren Zhen, étudiants de l’Université M Glogowskiat Loyola edité par Gergana Grigorova et Michal Olszewski, étudiants de l’Université M Glogowskiat Loyola edité par Alex Kula et Joanna Aiken, étudiants de l’Université M Glogowskiat Loyola