A Microbial Biorealm page on the genus Citrobacter freundii
Classification
Higher order taxa
Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Citrobacter
Species
NCBI: Taxonomy
Citrobacter Freundii
Description and significance
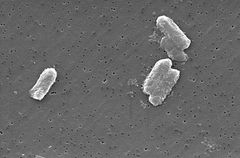 Photo: Pete Wardell / CDC
Photo: Pete Wardell / CDC
Citrobacter-lajit, mukaan lukien Citrobacter freundii, ovat aerobisia gramnegatiivisia basilleja. Citrobacter freundit ovat pitkiä sauvamaisia bakteereja, joiden pituus on tyypillisesti 1-5 µm . Useimpien C. freundii-solujen ympärillä on paljon liikkumiseen käytettäviä flagelloja, mutta muutamat ovat liikkumattomia. Sen elinympäristöä ovat ympäristö (maaperä, vesi, jätevesi), ravinto sekä eläinten ja ihmisten suolisto . Se kuuluu enterobakteerien (Enterobacteriaceae) heimoon.
opportunistisena patogeeninä C. freundii aiheuttaa useita merkittäviä opportunisti-infektioita. Sen tiedetään aiheuttavan erilaisia hengitysteiden, virtsateiden, veren ja useiden muiden normaalisti steriilien kohtien sairaalainfektioita potilailla . C. freundii edustaa noin 29% kaikista opportunistisista infektioista . Siksi yksi tärkeimmistä syistä monia erilaisia kantoja ja plasmideja C. freundii genomin sekvensoidaan on, jotta löytää antibiootteja, jotka voivat taistella näitä opportunistisia infektioita.
yllättäen tällä ihmisillä tarttuvalla mikrobilla on positiivinen rooli ympäristössä. C. freundii vastaa nitraatin pelkistämisestä ympäristössä nitriitiksi . Tämä ratkaiseva konversio on tärkeä vaihe typen kiertokulussa. Ja typen kierrättäminen on erittäin tärkeää, koska maan ilmakehässä on noin 85% typpeä . Siksi, koska sen tärkeä panos ympäristöön on toinen motivaatio sekvensoida genomin C. freundii.
Citrobacter-suvun löysivät Werkman ja Gillen vuonna 1932. C. freundiin viljelmät eristettiin ja tunnistettiin samana vuonna maauutteista .
genomin rakenne
tietoa C. freundiin koko genomista ei ole saatavilla verkossa, joskin joitakin mikrobin yksittäisiä kantoja ja plasmideja on sekvensoitu. Huomattavin on plasmidi pCTX-m#3, koska se on suurin plasmidi ja koodaa suuren määrän proteiineja. Sen jakso valmistui 6. tammikuuta 2005. Se on ympyränmuotoinen DNA-plasmidi ja siinä on 89 468 nukleotidiemäsparia pitkä. Plasmidin pituus on 0,089468 (Mbp). Se koostuu 51,0% GC-pitoisuudesta ja koodaa 105 proteiineja .
toinen tärkeä piirre C: ssä. freundii genomin mukaan se on enterobakteerien heimon ainoa mikrobi, joka sisältää L-metioniini-γ-lyaasia (MGL) koodaavan plasmidin. Plasmidin nukleotidisekvenssi sisältää 3000 bp pitkän EcoRI-insertin . Katkelma sisältää myös kaksi avointa lukukehystä. Ensimmäinen runko koostuu 1 194 nukleotidista ja toinen 1 296 nukleotidista.Ensimmäinen runko, joka tunnetaan megL-geeninä, koodaa 398 aminohapon jäämistä koostuvaa proteiinia, jolla on sekvenssihomologia MGL: ien kanssa eri lähteistä. Toinen runko koodaa valkuaisainetta sekvenssihomologialla permeaasien perheeseen kuuluvien proteiinien kanssa .
C. freundii OS60 AmpC β-laktamaasigeeni on myös sekvensoitu ja se koostuu 1197 nukleotidista. Se koodaa 380 aminohapon pitkää esiastetta ja sisältää 19 jäämäsignaalipeptidin 5′ – päässä . Tämä geeni koodaa kypsää proteiinia, jonka molekyylimassa on 39 781 daltonia. Näiden esiasteiden aminohappoasemat ovat suprisiinisesti identtisiä E. coli K12-kromosomaalisten AmpC-β-laktamaasien jäämien kanssa .
toinen tärkeä kanta C: n perimässä. freunii on GN346, joka on vuonna 1965 löydetty kliininen isolaatti. Tämä kanta tuottaa entsyymiä kefalosporinaasi, joka on kyky hydrolysoida ja inaktivoida anibitoic kefalosporiinit ja kefamysiinit . Kefalosporinaasigeenin rakenne-ja promoottorialueet ovat 1408 nukleotidin pituisia. Kypsän entsyymin aminohappojärjestys koostuu 361 aminohaposta, joiden molekyylimassa on 39 878 Da .
solurakenne ja metabolia
C. Freundin solurakenne on pitkä ja sauvamainen yleensä 1-5 µm pitkä. Solun ulkopinnalla on paljon motaalisuuteen käytettäviä flagelloja . Koska C. freundii on gramnegatiivinen bakteeri, siinä on kaksi kalvoa (sisempi ja ulompi).Periplasminen tila sijaitsee kahden kalvon välissä. Ulompi kalvo ei sisällä energialähdettä, mutta se sisältää monia poriineja, jotka auttavat eliötä hankkimaan tärkeitä ioneja . Toisin kuin grampositiiviset bakteerit, C. freundii-soluissa ei ole peptidoglykaanista koostuvaa paksua soluseinää.
aineenvaihdunnassa C. freundii on hämmästyttävä kyky kasvaa glyseroliin ainoana hiili-ja energianlähteenä. Tässä prosessissa glyseroli fermentoidaan hajottamalla. Tämä prosessi vaatii kaksi reittiä . Ensimmäisessä reitissä glyseroli dehydrogenoidaan nad1-sidotun glyserolidehydrogenaasin avulla dihydroksiasetoniksi. Dihydroksiasetoni fosforyloidaan ja suppiloidaan glykolyysiin dihydroksiasetonikinaasin avulla . Toisessa reitissä glyserolia dehydratoi koentsyymi B12: sta riippuvainen glyserolidehydroataasi, jolloin muodostuu 3-hydroksipropionaldehydiä . Tämä tuote pelkistetään tärkeimmäksi käymistuotteeksi 1,3-propaanidioliksi NADH-sidotulla 1,3-propaanidiolidehydrogenaasilla, joka regeneroi NAD1: tä. DHA regulon koodaa näiden kahden reitin neljä tärkeää entsyymiä. Hämmästyttävää kyllä, DHA Regulonin ilmentyminen syntyy vain glyserolin ollessa läsnä .
C. freundiin solut kykenevät myös metaboloimaan laktoosia tai sitraattia hiilen lähteenä .
ekologia
Citrobacter freundii esiintyy yleisesti ympäristössä, lähinnä maaperässä, vedessä ja viemäreissä. Ne ovat indikaattori veden mahdollisesta saastumisesta. Niitä on myös sairaiden eläinten, kuten nisäkkäiden, lintujen, matelijoiden ja sammakkoeläinten eri elimissä . Niiden ei tiedetä olevan vuorovaikutuksessa muiden organimien kanssa.
ympäristössä C. freundii voi muuttaa nitraatin tai ammoniumionin (joka on typpiatomi yhdistettynä neljään vetyatomiin) nitriitiksi; tämä reaktio tapahtuu ympäristössä sekä ihmisten ja muiden eläinten ruoansulatuskanavassa . Muutettuaan nitraatin ympäristössä nitriitiksi nitriitti muuttuu typeksi, ja tämä viimeinen vaihe päättää typen kierron Maan ilmakehässä, joka koostuu 85-prosenttisesti typestä . Tämän eliön ekologinen rooli ei sisällä vain sen tärkeää roolia typen kiertokulussa, koska se voi myös kerätä uraania (joka on ydinteknologian perusaine) rakentamalla fosfaattikomplekseja .
Citrobacter freundii-bakteeria on tutkittu myös tanneryseissa käytetyn parkkihapon biohajoavuuden vuoksi .
patologia
opportunistisena patogeeninä Citrobacter freundii on usein merkittävien opportunisti-infektioiden aiheuttaja, eli se ei yleensä aiheuta tautia terveissä ihmisisännissä. Ne vaikuttavat vain potilailla, joilla on heikko immuunijärjestelmä, mikä tarkoittaa, että he tarvitsevat ”mahdollisuuden” tartuttaa henkilö . Siksi potilailla, joilla on tukahdutettu immuunijärjestelmä, Citrobacter-lajien tiedetään aiheuttavan monenlaisia hengitysteiden, virtsateiden ja veren sairaalainfektioita . Maksa -, sappi-ja haimasairaudet ovat myös yleisiä C. freundiin aiheuttamia sairauksia. Sappiteiden on yleisin paikka tartunnan C. freundii basilli .
yksi kuolemaan johtava sairaus, johon C. freundii on liittynyt, on vastasyntyneen aivokalvontulehdus. Vastasyntyneen aivokalvontulehdus on tulehdus aivokalvot (järjestelmä kalvoja, jotka ympäröivät CNS) johtuu bakteerien invaasio . Citrobacter-aivokalvontulehduksen kuolleisuus on sietämättömän korkea, sillä potilaiden kuolleisuus vaihtelee 25-50 prosentin välillä. Lisäksi vakavia neurologisia ongelmia on edelleen 75 prosentilla eloonjääneistä. Tässä taudissa Citrobacter freundii pystyy läpäisemään veri-aivoesteen, joka koostuu suonikalvon pleksiepiteelistä ja aivojen kapillaari-endoteelista .
mäyrä et: n tekemät testit. al: n artikkelissa ”Citrobacter freundii tunkeutuu ihmisaivojen Mikrovaskulaarisiin endoteelisoluihin ja replikoituu niihin”esitetään, että C. freundii-bakteerin lisääntyminen tapahtuu solunsisäisellä tasolla, mikä oli ollut vastoin yleistä tieteellistä käsitystä. Havainnot osoittavat, että C. freundii kulkee vakuolien läpi, replikoituu ja vapautuu ihmisaivojen mikrovaskulaaristen endoteelisolujen (HBMEC) basolateraaliseen puoleen ylittääkseen veri-aivoesteen. Lisäanalyysin avulla voidaan mahdollisesti laatia hoitostrategioita infektioiden hoitamiseksi. Terapeuttista hoitoa ei ole vielä saatavilla .
tietyt taimenilla ja särkikaloilla tutkitut sairaudet ovat myös C. freundiin aiheuttamia. C. freundii aiheuttaa poikkeavia tulehdusmuutoksia taimenten suolistossa ja tulehduksellisia ja nekroottisia muutoksia särkikalojen sisäelimissä. Sairaus löydettiin keinotekoisen infektion avulla puhtaalla C. freundii-viljelmällä. Tämä löytö vahvisti C. freundiin kalataudin aiheuttajaksi .
Journal of Medical Microbiology-lehden tapaustutkimuksessa potilaalle kehittyi Citrobacter freundii-bakteerin aiheuttama vatsakalvontulehdus ja tunneliinfektio, joka on harvinaista. Potilas oli jatkuvassa avohoidossa peritoneaalidialyysissä. Yleensä aiheuttajina ovat grampositiiviset mikro-organismit, erityisesti Staphylococcus aureus ja Staphyloccus edpidermis. Myöskään C. freundii-bakteerin aiheuttamasta tunneliinfektiosta ei ole tiedossa. Alkuperäinen antibioottihoito ei tehonnut ja tulehdus jatkui katetrin poistamiseen asti. Tämä on kliinisesti merkittävää, koska Citrobacter Freundii – bakteerilla on erilainen antibioottiherkkyys, minkä vuoksi aloitushoito ei onnistunut. Potilas ei reagoinut hoitoon ennen katetrin poistoa, mikä osoitti Citrobacter freundii: n olevan opportunistisia patogeeneja, jotka vaikuttavat sairaalahoidossa oleviin ja immuunivajauspotilaisiin .
soveltaminen bioteknologiaan
Bioteknologiateollisuudessa Citrobacter freundii tuottaa monia tärkeitä entsyymejä.Ensimmäinen sen tuottama entsyymi on fosfataasi. C: n fosfataasiaktiivisuus. freundiin on oletettu osallistuvan lyijyn kertymiseen, jolla voi olla tärkeä rooli Bioteknisessä teollisuudessa. Myös C. freundiin fosfataasitoiminnalla on havaittu olevan vastustuskykyä joillekin diagnostisille reagensseille .
bakteerin selenokysteiinibeetalyaasin, entsyymin, joka erityisesti katalysoi l-selenokysteiinin pilkkoutumista l-alaniiniksi, puhdistus ja luonnehdinta on puhdistettu Citrobacter freundiista. Entsyymi on monomeerinen ja sen molekyylipaino on ca. 64 000 ja sisältää 1 mol pyridoksaali-5′ – fosfaattia kofaktorina per mol entsyymiä. Entsyymi katalysoi myös beeta-kloori-L-alaniinin alfa -, beeta-eliminaatiota, jolloin muodostuu NH3, pyruvaatti .
C. Freundii-kannoissa on myös plasmidi, joka koodaa luokan 1 AmpC kefalosporinaasia. Nämä entsyymit voivat hydrolzye inaktivoida uusia kefamysiinejä ja kefalosporiineja .
nykytutkimus
pienimuotoinen tutkimus C. freundiin tietyistä kannoista tehtiin hiljattain Tennesseen yliopistossa Knoxvillessä. Tiettyjen tetrasykliini-ja streptomysiiniresistenssigeenien ja luokan 1 integronien merkitys C: ssä. maitotilojen maaperästä ja kuivaamattomasta maaperästä eristetyt freundit arvioitiin. Yhdessä maitotilojen maaperästä uutetussa C. freundii-kannassa oli luokan 1 integroneja, joihin oli lisätty erilaisia geenikasetteja. Tämän pienen tutkimuksen tulokset viittasivat siihen, että useiden resistenssigeenien ja luokan 1 integronien esiintyminen C. freundii-bakteerissa maitotilan maaperässä voi toimia mikrobilääkeresistenssigeenien varastona ja vaikuttaa näiden mikrobilääkeresistenssigeenien leviämiseen muihin vastaaviin ja alkuperäisiin mikrobiyhteisöihin maaperässä. Tämän hypoteesin tueksi tarvitaan kuitenkin pidempiaikaisia lisätutkimuksia useammassa paikassa .
toinen C. freundii-tutkimus tehtiin polymeraasiketjureaktiomenetelmän (PCR) kehittämiseksi, jossa käytetään samanaikaisesti kolmea paria spesifisiä alukkeita tiettyjen mikrobien (mukaan lukien C. freundii) geenien havaitsemiseen. Menetelmään kuului kolmen alukeparin suunnittelu, jotka olivat: SPVC-1 ja SPVC-2, INVA-1 ja INVA-2 sekä VIAB-1 ja VIAB-2. PCR tehtiin käyttämällä näitä kolmea aluketta 14 kliinisesti tärkeän bakteeriorganismin tunnistamiseksi. Seuraavat kannat tunnistettiin nopeasti PCR: n avulla: 1) C. freundii, 2) S. Typhi ja S. Paratyphi C, 3) S. Dublin (virulenssi-antigeenipositiivinen) ja 4) Salmonella-serovaarit, joissa on spv-tyypin virulenssiplasmidi. Vaikka tämä PCR-menetelmä on uusi, tekniikan kehittyessä tulevaisuudessa tämä menetelmä voi mahdollistaa C. freundii-bakteerin tunnistamisen nisäkkäistä välittömästi, jotta asianmukainen antibioottihoito voidaan aloittaa viipymättä .
kolmas C. freundiin liittyvä tutkimus tehtiin Barcelonan yliopistossa Espanjassa. Fluorokinoloniresistenssin mekanismeja tutkittiin kahdessa Citrobacter freundii-kannassa. Molemmat kannat eristettiin samalta potilaalta. Tämä tutkimus mahdollisti tämän mikro-organismin acrA-ja acrB-geenien osittaisen luonnehdinnan. Molempien kantojen geenien ilmentyminen analysoitiin DNA-mikrorakenteilla Escherichia coli-bakteeria varten. C. freundii-ja E. coli-bakteerien osittain sekvensoitujen acrA-ja acrB-geenien nukleotidien samankaltaisuus oli 80, 7% ja E. coli-bakteerien 85%. C. freundiin acrA-ja acrB-geenit ovat samanlaisia kuin E: ssä. kolibakteerit ja niiden yliekspressio voivat olla tärkeässä asemassa moduloitaessa fluorokinolonien pienintä estävää pitoisuutta .
neljäs C. freundia koskeva tutkimus tehtiin Taiwanissa. Tutkijaryhmä eristi diabeetikon, jolle kehittyi C. freundii-bakteerin aiheuttama nekrotisoiva faskiitti merieläimen aiheuttamasta vammasta. Nekrotisoiva fasciitti on infektio syvemmälle kerros ihon ja ihonalaisen kudosten. Hoitaessaan potilasta he ottivat näytteen haavan nesteestä ja löysivät C. freundiin. Kolmen päivän kuluttua kefotaksmiini-ja kefepmiinihoitojen aloittamisesta havaittiin ihonalaisten paiseiden kertymistä. Kun potilasta oli hoidettu 6, 10, 14 ja 21 päivää, jotkut antibiootit antoivat potilaalle jonkin verran helpotusta, mutta pitkäaikaista paranemista ei saavutettu. Kefotoaksiimi, kefepiimi, siprofloksamiini kuuluvat antibiootteihin, jotka eivät vastanneet C. freundii-bakteeria. Potilas toipui täysin 42 päivän ertapeneemihoidon jälkeen. Tutkijat olivat eristäneet kaksi C. freundiin pesäkettä 5 päivän sisällä toisistaan. Kun isolaatit kasvoivat, niistä tuli äärettömän resistenttejä kefotaksiimille ja kefepiimille. Syy siihen, miksi entrapenem tehosi C. freundii-bakteeria vastaan, on se, että se on aktiivinen Enterobakteereita tuottavia AmpC-bakteereita vastaan .
antibioottiresistenssi
Citrobacter-lajit ovat yleinen sairaalainfektioiden aiheuttaja potilailla, jotka saavat pitkäaikaista sairaalahoitoa. C. freundiin on äskettäin raportoitu olevan resistentti laajakirjoisille antibiooteille, kuten piperasilliinille, piperasillintatsobaktaamille, vankomysiinille ja kefalosporiineille. Keftriaksoniresistentin Citrobacter freundii-bakteerin (CRCF) eristäminen on yhdistetty ylikirjaviin laajakirjoisiin antibiootteihin. Uudet CRCF-kannat voivat viitata resistenssigeenien induktioon tai depressioon sekä kilpailevien organismien eliminointiin. CRCF on pääosin eristetty potilailla, joilla on merkittäviä oheissairauksia, kuten AIDS, ääreisverisuonitauti ja aivoverisuonitauti. Fluorokinolonin käytöllä ei myöskään ole raportoitu olevan vaikutusta CRCF: n eristämiseen .
Citrobacter freundii: n tiedetään myös sisältävän kromosomissaan kefalosporinaasia koodaavan geenin. Tämä entsyymi hydrolysoi−CO− NH-sidoksen kefalosporiinien ja kefamysiinin laktaamirenkaassa, mikä tekee bakteereista vastustuskykyisiä tämäntyyppisille antibiooteille. Altistuessaan uudelle kolmannen sukupolven kefeemille ja cerbapeneemeille kliinisesti eristetty C. freundii osoitti kuitenkin herkkyyttä näille aineille.Nagoyan yliopistollisen sairaalan kirurgisella osastolla potilailla, joille tehtiin kirurgisia toimenpiteitä, on havaittu pieni C. freundii-taudin puhkeaminen, joka on vastustuskykyinen kolmannen sukupolven kefeemeille. C. freundii eristettiin potilaan sapesta, haavan harsosta, ulosteesta, mätästä ja askiiteista. Ehdotettiin, että nämä uudet C. freundii-kannat sisälsivät plasmidin, joka koodaa AmpC-celfalosporinaasia, mutta kun C. freundii-bakteerin kefeemiresistenssiä ei onnistuttu siirtämään E. coli-bakteeriin, päädyttiin siihen, että entsyymi on koodattava C. freundii-bakteerin kromosomiin. Koska C. freundiin liittyy sairaalainfektioita, suositellaan varovaisuutta näiden uusien kantojen suhteen .
1. Wang JT, Chang SC, Chen YC, Luh KT. ”Citrobacter freundii: n mikrobilääkeherkkyyden vertailu eristää kahdessa eri aikajaksossa.”Journal of Microbiology, Immunology and Infection. 2000 joulu; 33 (4): 258-62.
2. Whalen JG, Mully TW, Enlgish JC 3rd. ”Spontaani Citrobacter freundii-infektio immunokompetentilla potilaalla.”Archives of dermatology. 2007 tammi; 143(1): 124-5.
3. Puchenkova SG. ”Enterobakteerit vesialueilla Krimin rannikolla.”Mikrobiolohichnyĭ zhurnal. 1996 Maalis-Huhti; 58(2): 3-7.
4.http://www.ncbi.nlm.nih.gov/sites/entrez?db=genomeprj&cmd=Retrieve&dopt=Overview&list_uids=13123
5. Ilya V. Manuhov, Daria V. Mamaeva, Sergei M. Rastorgujev, Nicolai G. Faleev, Elena A. Morozova, Tatjana v. Demidkina ja Gennadii B. Zavilgelski. ”L-metioniini γ-Lyaasia koodaava geeni esiintyy Enterobacteriaceae-suvun Genomeissa: Citrobacter freundii L-metioniini γ-lyaasin tunnistaminen ja luonnehtiminen.”Journal of Bakteriology. 2005 Kesäkuu; 187 (11): 3889-3893.
6. Lindberg, Frederik; Westman, Lennart; Normark, Staffan. ”Säätelykomponentit Citrobacter freundii AMPC β-laktamaasi-induktiossa.”Proceedings of the National Academy of Sciences of the United States of America. 1985 Heinäkuu; 82 (14): 4620-4624.
7. Tsukamoto K, Tachibana K, Yamazaki n, Ishii Y, Ujiie K, Nishida N, Sawai T. ”lysiini-67: n rooli C-luokan beetalaktamaasin aktiivisessa paikassa Citrobacter freundii GN346: sta.”European Journal of Biochemistry / FEBS. 1990 helmi 22; 188 (1): 15-22.
8. Keevil CW, Hough JS, Cole JA. ”Citrobacter freundii: n prototrofinen kasvu ja sen ilmeisten kasvuvaatimusten biokemiallinen perusta ilmastetuissa väliaineissa.”Journal of General Microbiology. 1997 Tammi; 98 (1): 273-6.
9. Marco Sánchez F, Turabian Fernández JL, Durán Pérez-Navarro A. ”Kohtalokas Citrobacter Freundii Bronchopneumonia, joka on hankittu yhteisössä – tinkimättömällä potilaalla.”Revista Clínica Española. 1985 huhti; 176 (6): 320
10. Julie L. Badger, Monique F. Stins ja Kwang Sik Kim. ”Citrobacter freundii tunkeutuu ihmisaivojen Mikrovaskulaarisiin endoteelisoluihin.””Hinyokika kiyo. Acta Urologica Japonica. 1985 heinä; 31 (7): 1159-70.
11. Drelichman V, yhtye JD. ”Bakteremiat, jotka johtuvat Citrobacter diversuksesta ja Citrobacter freundiista. Ilmaantuvuus, riskitekijät ja kliininen tulos.”Archives of Internal Medicine. 1985 loka; 145 (10): 1808-10.
12. Srinivasan V, Nam HM, Sawant AA, Headrick SI, Nguyen LT, Oliver SP. ”Tetrasykliini-ja Streptomysiiniresistenssigeenien ja luokan 1 Integronien jakautuminen Enterobacteriaceae-bakteereissa, jotka on eristetty maitotilan maaperästä ja Nondairy-viljelymaasta.”Mikrobiekologia. 2007 elo 15.
13. Sánchez-Céspedes J, Vila J. ” Acrab-lokuksen osittainen Luonnehdinta kahdessa Citrobacter freundii – kliinisessä isolaatissa.”International Journal of Antimicrobial Agents. 2007 syys; 30 (3): 259-63.
14. Ciğerci IH, Korcan SE, Konuk M, Oztürk S. ”Citrobacter-ja Pseudomonas-kantojen alad-toiminnan vertailu ja niiden käyttö biomarkkerina Pb-kontaminaatiossa.”Ympäristön seuranta ja arviointi. 2007 toukokuun 22.
15. Chocat P, Esaki N, Tanizawa K, Nakamura K, Tanaka H, Soda K. ” Puhdistus ja luonnehdinta Selenokysteiini beeta-lyaasin Citrobacter freundii.”Journal of Bakteriology. 1985 Aug; 163 (2): 669-76.
16. Hillel S Levinson, Inga Mahler. ”Fosfataasiaktiivisuus ja lyijy resistenssi Citrobacter freundii ja Staphylococcus aureus.”FEMS Microbiology Letters. 1998 huhti; 161 (1): 135-138.
17. Murakami K, Yoshida T. ” Moksalaktaamin kovalenttinen sitoutuminen Citrobacter freundiin kefalosporinaasiin.”Mikrobilääkkeet ja kemoterapia. 1985 toukokuu; 27(5): 727-32.
18. Dervisoglu, E., Yegenaga, I., Yumuk, Z. ” Citrobacter Freundii peritoniitti ja tunneli infektio potilaan jatkuva avohoidossa peritoneaalidialyysissä.”Journal of Medical Microbiology, 2008. Osa 57. s. 125-127.
19. Kim PW, Harris AD, Roghmann MC, Morris JG Jr, Strinivasan a, Perencevich EN. ”Epidemiological risk factors for isolation of Ceftriaxone-resistent versus-sensitive citrobacter freundii in hospitalized patients” Antimicrob Agents Chemother, 2003 Sep; 47 (9): s.2882-2887.
20. Nada T, Baba H, Kawamura K, Ohkura T, Torii K, Ohta M. ”pieni puhkeaminen kolmannen sukupolven cephem-resistentti Citrobacter freundii infektio kirurgisella osastolla” Jpn J Infect Dis. 2004 ELO;57 (4): s.181-182.
21. Chuang, Y., Tseng, S., Teng, L., Ho, Y. ja Hsueh, P. ”Emergence of cefotaxime resistance in Citrobactor freundii causing necrotizing fasciitis and osteomyelitis” Journal of Infection, 2006. Osa 53. s. e161-e163.
22.Badger, J., Stins, M. ja Sik Kim, K. ”Citrobacter freundii Invades and Replikates in Human Brain Microvaskular Endothelial Cells” Infection and Immunity, 1999. Volume67. P. 4208-4215.
Edited by Sumaira Akbarzada, student of Rachel LarsenEdited by Greg Vargas ja Darren Zhen, students of M Glogowskiat Loyola UniversityEdited by Gergana Grigorova ja Michal Olszewski, students of M Glogowskiat Loyola UniversityEdited by Alex Kula ja Joanna Aiken, students of M Glogowskiat Loyola University