A Microbial Biorealm page on the genus Citrobacter freundii
Classification
Higher order taxa
Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Citrobacter
Species
NCBI: Taxonomy
Citrobacter Freundii
Description and significance
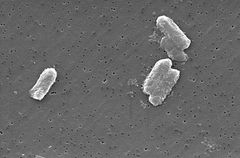 Photo: Pete Wardell / CDC
Photo: Pete Wardell / CDC
Le specie Citrobacter, tra cui Citrobacter freundii, sono bacilli gram-negativi aerobici. Citrobacter freundii sono lunghi batteri a forma di bastoncello tipicamente 1-5 µm di lunghezza . La maggior parte delle cellule di C. freundii sono circondate da molti flagelli usati per muoversi, ma alcuni sono non mobili. Il suo habitat comprende l’ambiente (suolo, acqua, acque reflue), cibo e tratti intestinali di animali e umani . Appartiene alla famiglia delle Enterobacteriaceae.
Come agente patogeno opportunistico, C. freundii è responsabile di una serie di infezioni opportunistiche significative. È noto per essere la causa di una varietà di infezioni nosocomiali delle vie respiratorie, delle vie urinarie, del sangue e di molti altri siti normalmente sterili nei pazienti . C. freundii rappresenta circa il 29% di tutte le infezioni opportunistiche . Pertanto, uno dei motivi principali per cui molti diversi ceppi e plasmidi del genoma di C. freundii vengono sequenziati è quello di trovare antibiotici in grado di combattere queste infezioni opportunistiche.
Sorprendentemente, questo microbo infettivo nell’uomo svolge un ruolo positivo nell’ambiente. C. freundii è responsabile della riduzione del nitrato in nitrito nell’ambiente . Questa conversione cruciale è una tappa importante nel ciclo dell’azoto. E riciclare l’azoto è molto essenziale perché l’atmosfera terrestre è di circa l ‘ 85% di azoto . Pertanto, a causa del suo importante contributo all’ambiente è un’altra motivazione per il sequenziamento del genoma di C. freundii.
Il genere Citrobacter fu scoperto nel 1932 da Werkman e Gillen. Le colture di C. freundii sono state isolate e identificate nello stesso anno da estratti di terreno .
Struttura del genoma
Nessuna informazione sul genoma completo di C. freundii è disponibile online, sebbene alcuni singoli ceppi e plasmidi del microbo siano stati sequenziati. Il più importante è il plasmide pCTX-M#3 perché è il plasmide più grande e codifica una grande quantità di proteine. La sua sequenza è stata completata il 6 gennaio 2005. È un plasmide circolare del DNA ed è lungo 89.468 coppie di basi nucleotidiche. La lunghezza del plasmide è 0,089468 (Mbp). È composto da 51,0% di contenuto di GC e codifica 105 proteine .
Un’altra caratteristica importante del C. genoma di freundii è che è l’unico microbo della famiglia Enterobacteriaceae che contiene un plasmide che codifica L-metionina γ-liasi (MGL). La sequenza nucleotidica del plasmide contiene un inserto EcoRI lungo 3000 bp . Il frammento contiene anche due fotogrammi di lettura aperti. Il primo frame è costituito da 1.194 nucleotidi e il secondo da 1.296 nucleotidi.Il primo frame, noto come gene megL, codifica una proteina di 398 residui di amminoacidi che ha omologia di sequenza con MGL da diverse fonti. Il secondo frame codifica una proteina con omologia di sequenza con proteine appartenenti alla famiglia delle permeases .
Il gene C. freundii OS60 AmpC β-lattamasi è stato sequenziato ed è composto da 1197 nucleotidi. Codifica un precursore lungo dell’aminoacido 380 e contiene un peptide del segnale del residuo 19 nell’estremità 5′. Questo gene codifica una proteina matura che ha una massa molecolare di 39 781 Dalton. Le posizioni dell’amminoacido in questi precursori sono suprisinlgy identiche ai residui nelle β-lattamasi cromosomiche dell’AmpC di E. coli K12 .
Un altro ceppo importante nel genoma di C. freunii è GN346, che è un isolato clinico recuperato nel 1965. Questo ceppo produce l’enzima cefalosporinasi, che ha la capacità di idrolizzare e inattivare le cefalosporine e le cefamicine anibitoiche . Le regioni strutturali e promotrici del gene cefalosporinasi sono lunghe 1408 nucleotidi. La sequenza aminoacidica dell’enzima maturo, è composta da 361 aminoacidi con una massa molecolare di 39.878 Da .
Struttura cellulare e metabolismo
La struttura cellulare di C. freundi è lunga e a forma di bastoncello di solito 1-5 µm di lunghezza. L’esterno della cella contiene molti flagelli usati per la motalità . Poiché C. freundii è un batterio gram-negativo, contiene due membrane (interne ed esterne).Lo spazio periplasmico si trova tra le due membrane. La membrana esterna non contiene una fonte di energia; ma contiene molte porine incorporate all’interno che aiutano l’organismo ad acquisire ioni importanti . A differenza dei batteri gram-positivi, le cellule di C. freundii non contengono una parete cellulare spessa costituita da peptidoglicano.
Per il metabolismo, C. freundii ha una straordinaria capacità di crescere sul glicerolo come unica fonte di carbonio ed energia. In questo processo, il glicerolo viene fermentato da un processo di dismutazione. Questo processo richiede due percorsi . Nella prima via, il glicerolo è deidrogenato da una glicerolo deidrogenasi NAD1-collegata a diidrossiacetone. Il diidrossiacetone viene quindi fosforilato e incanalato in glicolisi dalla chinasi diidrossiacetone . Nella seconda via, il glicerolo è disidratato dal coenzima B12-dipendente glicerolo disidratasi per formare 3-idrossipropionaldeide . Questo prodotto è ridotto al principale prodotto di fermentazione 1,3-propandiolo dalla deidrogenasi 1,3-propandiolo legata al NADH, che rigenera NAD1. Il dha regulon codifica i quattro enzimi essenziali di queste due vie. Sorprendentemente, l’espressione del dha regulon è indotta solo quando è presente glicerolo .
Le cellule di C. freundii sono anche in grado di metabolizzare il lattosio o il citrato come fonte di carbonio .
Ecologia
I Citrobacter freundii si trovano comunemente nell’ambiente, principalmente nel suolo, nell’acqua e nelle fognature. Sono un indicatore della potenziale contaminazione dell’acqua. Si trovano anche su diversi organi di animali malati, tra cui mammiferi, uccelli, rettili e anfibi . Non sono noti per interagire con altri organim.
Nell’ambiente, C. freundii può convertire il nitrato o lo ammonium ammonio (che è un atomo di azoto combinato con quattro atomi di idrogeno) in nitrito; questa reazione si verifica nell’ambiente e nel tratto digestivo degli esseri umani e di altri animali . Dopo che converte il nitrato in nitrito nell’ambiente, il nitrito viene convertito in azoto e questo passaggio finale completa il ciclo dell’azoto nell’atmosfera terrestre, che è costituito da 85% di azoto . Il ruolo ecologico di questo organismo non solo include il suo importante ruolo nel ciclo dell’azoto, perché può anche accumulare uranio (che è il materiale di base per la tecnologia nucleare) costruendo complessi di fosfati .
Citrobacter freundii è stato anche studiato per la biodegradazione dell’acido tannico utilizzato in tannerys .
Patologia
Come agente patogeno opportunistico, il Citrobacter freundii è spesso la causa di infezioni opportunistiche significative, il che significa che generalmente non causa malattie in ospiti umani sani. Colpiscono solo i pazienti con un sistema immunitario debole, a significare che hanno bisogno di una “opportunità” per infettare la persona . Pertanto, nei pazienti con un sistema immunitario soppresso, le specie di Citrobacter sono note per causare un’ampia varietà di infezioni nosocomiali delle vie respiratorie, delle vie urinarie e del sangue . Le malattie epatiche, biliari e pancreatiche sono anche malattie comuni causate da C. freundii. Il tratto biliare è il sito più comune di infezione da bacilli C. freundii .
Una malattia fatale a cui C. freundii è stato associato è la meningite neonatale. La meningite neonatale è l’infiammazione delle meningi (il sistema di membrane che circondano il SNC) a causa dell’invasione batterica . Il tasso di mortalità della meningite Citrobacter è inaccettabilmente alto, con tassi di mortalità dei pazienti che vanno dal 25 al 50 %. Inoltre, gravi problemi neurologici persistono ancora nel 75% dei sopravvissuti. In questa malattia, Citrobacter freundii è in grado di penetrare la barriera emato-encefalica che consiste nell’epitelio del plesso coroide e nell’endotelio capillare cerebrale .
Test eseguiti da Badger et. al nell’articolo “Citrobacter freundii Invade e replica nelle cellule endoteliali microvascolari del cervello umano” suggeriscono che la proliferazione batterica di C. freundii avviene a livello intracellulare, che era stato contrario al pensiero scientifico generale. I risultati indicano che C. freundii attraversa i vacuoli, si replica e viene rilasciato nel lato basolaterale delle cellule endoteliali microvascolari del cervello umano (HBMEC) per attraversare la barriera emato-encefalica. Ulteriori analisi possono potenzialmente consentire strategie terapeutiche per trattare le infezioni. Non esiste ancora un trattamento terapeutico disponibile .
Alcune malattie studiate nella trota e nei ciprinidi sono anche causate da C. freundii. C. freundii provoca alterazioni infiammatorie anormali nell’intestino della trota e cambiamenti infiammatori e necrotici negli organi interni dei ciprinidi. La malattia è stata scoperta per mezzo di infezione artificiale con una coltura pura di C. freundii. Questa scoperta ha stabilito C. freundii come causa della malattia dei pesci .
In un caso di studio del Journal of Medical Microbiology, un paziente ha sviluppato peritonite e infezione del tunnel a causa di Citrobacter freundii che è raro. Il paziente era in dialisi peritoneale ambulatoriale continua. Di solito gli agenti causanti sono microrganismi gram-positivi, in particolare Staphylococcus aureus e Staphyloccus edpidermis. Inoltre non ci sono rapporti noti di infezione del tunnel a causa di C. freundii. La terapia antibiotica iniziale non ha funzionato e l’infezione ha continuato a persistere fino alla rimozione del catetere. Ciò è clinicamente significativo perché Citrobacter Freundii mostra diversa suscettibilità agli antibiotici, motivo per cui la terapia iniziale non ha avuto successo. Il paziente non ha risposto al trattamento fino a quando il catetere è stato rimosso mostrando Citrobacter freundii sono patogeni opportunisti che colpiscono i pazienti ospedalizzati e immunocompromessi .
Applicazione alle biotecnologie
Nel settore Biotech, Citrobacter freundii produce molti importanti enzimi.I primi enzimi che produce è la fosfatasi. Attività della fosfatasi di C. freundii è stato postulato per essere coinvolto nell’accumulo di piombo, che può avere un ruolo importante nel settore Biotech. L’attività della fosfatasi di C. freundii inoltre è stata scoperta per avere resistenza ad alcuni reagenti diagnostici .
La purificazione e la caratterizzazione della selenocisteina batterica beta-liasi, un enzima che catalizza specificamente la scissione della L-selenocisteina in L-alanina, è stata purificata da Citrobacter freundii. L’enzima è monomerico con un peso molecolare di ca. 64.000 e contiene 1 mol di piridossale 5 ‘ – fosfato come cofattore per mol di enzima. L’enzima catalizza anche l’alfa, beta eliminazione di beta-cloro-L-alanina per formare NH3, piruvato .
C. I ceppi Freundii portano anche un plasmide che codifica la cefalosporinasi AmpC di classe 1. Questi enzimi possono idrolizzare inattivare nuove cefamicine e cefalosporine .
Ricerca attuale
Una ricerca su piccola scala riguardante alcuni ceppi di C. freundii è stata fatta di recente presso l’Università del Tennessee, Knoxville. L’importanza di alcuni geni di resistenza alla tetraciclina e alla streptomicina e degli integroni di classe 1 in C. sono stati valutati i freundii isolati dal terreno dell’azienda lattiero-casearia e dai terreni non lattiero-caseari. Un ceppo di C. freundii estratto da terreni agricoli da latte trasportava integroni di classe 1 con diverse cassette genetiche inserite. I risultati di questo piccolo studio hanno suggerito che la presenza di geni di resistenza multipla e di integroni di classe 1 in C. freundii nel terreno dell’azienda lattiero-casearia può agire come un serbatoio di geni di resistenza antimicrobica e potrebbe svolgere un ruolo nella diffusione di questi geni di resistenza antimicrobica ad altre comunità microbiche commensali e indigene nel suolo. Tuttavia, sono necessari ulteriori studi a lungo termine condotti in più sedi per supportare questa ipotesi .
Una seconda ricerca concering C. freundii è stato fatto al fine di elaborare un metodo di reazione a catena della polimerasi (PCR) che utilizza contemporaneamente tre coppie di primer specifici per rilevare i geni di alcuni microbi (tra cui C. freundii). Il metodo comprendeva la progettazione di tre coppie di primer che erano: SPVC – 1 e SPVC-2, INVA-1 e INVA-2; e VIAB-1 e VIAB-2. La PCR è stata eseguita utilizzando questi tre primer per identificare 14 organismi batterici clinicamente importanti. I seguenti ceppi sono stati rapidamente identificati utilizzando la PCR: (1) C. freundii; (2) S. Typhi; e S. Paratyphi C; (3) S. Dublin (virulenza antigene-positivo); e (4) sierotipi di salmonella che ospitano un plasmide di virulenza di tipo spv. Sebbene questo metodo PCR sia nuovo, con il progresso della tecnologia in futuro questo metodo può consentire l’identificazione di C. freundii nei mammiferi immediatamente in modo che un adeguato trattamento antibiotico possa essere avviato senza indugio .
Un terzo studio concering C. freundii è stato fatto presso l’Università di Barcellona, Spagna. Sono stati studiati i meccanismi di resistenza ai fluorochinoloni in due ceppi di Citrobacter freundii. Entrambi i ceppi sono stati isolati dallo stesso paziente. Questo studio ha permesso la caratterizzazione parziale dei geni acrA e acrB di questo microrganismo. L’espressione dei geni in entrambi i ceppi è stata analizzata utilizzando microarray di DNA per Escherichia coli. La somiglianza nucleotidica tra i geni ACRA e acrB parzialmente sequenziati di C. freundii ed E. coli era rispettivamente dell ‘80,7% e dell’ 85%. I geni acrA e acrB di C. freundii sono simili a quelli di E. coli e la loro sovraespressione possono svolgere un ruolo importante nel modulare la concentrazione inibitoria minima finale dei fluorochinoloni .
Un quarto studio riguardante C. freundii è stato fatto a Taiwan. Un team di ricercatori ha isolato un paziente diabetico che ha sviluppato fascite necrotizzante causata da C. freundii da una lesione istigata da un animale marino. La fascite necrotizzante è un’infezione all’interno dello strato più profondo della pelle e dei tessuti sottocutanei. Durante il trattamento del paziente hanno preso un campione dal liquido nella ferita e hanno trovato C. freundii. Dopo tre giorni dall’inizio dei trattamenti antibiotici con cefotaxmina e cefepmina, si è verificato un accumulo di ascessi sottocutanei. Dopo 6, 10, 14 e 21 giorni di cura del paziente, alcuni antibiotici stavano dando al paziente un certo sollievo, ma non è stato raggiunto alcun recupero a lungo termine. Cefotoaxime, cefepime, ciprofloxamin sono fra gli antibiotici che non erano partita per C. freundii. Il paziente si è ripreso completamente dopo 42 giorni di trattamento con erapenem. I ricercatori avevano isolato due colonie di C. freundii entro 5 giorni l’una dall’altra. Man mano che gli isolati venivano coltivati, diventavano immensamente resistenti a cefotaxime e cefepime. Il motivo per cui entrapenem ha lavorato contro C. freundii è perché è attivo contro AMPC producendo Enterobacteriaceae .
Resistenza agli antibiotici
Le specie di citrobacter sono una causa comune di infezioni nosocomiali associate a pazienti sottoposti a trattamenti ospedalieri prolungati. C. freundii è stato recentemente segnalato per esprimere resistenza agli antibiotici ad ampio spettro tra cui piperacillina, piperacillintazobactam, vancomicina e cefalosporine. L’isolamento del Citrobacter freundii resistente al ceftriaxone (CRCF) è stato associato agli antibiotici ad ampio spettro sovraprescritti. I nuovi ceppi CRCF emergenti potrebbero suggerire l’induzione o la depressione di geni di resistenza e l’eliminazione di organismi concorrenti. La CRCF è stata per lo più isolata da pazienti con comorbidità significative tra cui AIDS, malattia vascolare periferica e malattia cerebrovascolare. L’uso di fluorochinolone inoltre è stato riferito per non avere effetto contro l’isolamento di CRCF .
Citrobacter freundii è anche noto per contenere nel suo cromosoma un gene che codifica per la cefalosporinasi. Questo enzima idrolizza− CO-NH-legame nell’anello lattamico di cefalosporine e cefamiciè rendendo così i batteri resistenti a questo tipo di antibiotici. Tuttavia, quando esposto a nuovi cefemi e cerbapenemi di terza generazione, C. freundii clinicamente isolato ha mostrato sensibilità a tali sostanze.Un piccolo focolaio di C. freundii resistente ai cefemi di terza generazione è stato osservato nel reparto chirurgico dell’Ospedale universitario di Nagoya in pazienti sottoposti a procedure chirurgiche. Il C. freundii è stato isolato dalla bile del paziente, dalla garza della ferita, dalle feci, dal pus e dall’ascite. È stato suggerito che questi nuovi ceppi di C. freundii contenessero un plasmide codificante AmpC celfalosporinasi, ma in caso di mancato trasferimento della resistenza dei cefemi da C. freundii a E. coli si è concluso che l’enzima deve essere codificato nel cromosoma di C. freundii. Poiché C. freundi è associato a infezioni nosocomiali si raccomanda cautela nei confronti di questi nuovi ceppi .
1. Wang JT, Chang SC, Chen YC, Luh KT. “Confronto della suscettibilità antimicrobica degli isolati Citrobacter freundii in due diversi periodi di tempo.”The Journal of Microbiology, Immunology and Infection. 2000 Dicembre; 33 (4): 258-62.
2. Whalen JG, Mully TW, Enlgish JC 3°. “Infezione spontanea di Citrobacter freundii in un paziente immunocompetente.”Archives of dermatology. 2007 Gennaio; 143 (1): 124-5.
3. Puchenkova SG. “Enterobatteri in aree di acqua lungo la costa della Crimea.”mikrobiolohichny zh zhurnal. 1996 Mar-Apr; 58 (2): 3-7.
4.http://www.ncbi.nlm.nih.gov/sites/entrez?db=genomeprj&cmd=Retrieve&dopt=Overview&list_uids=13123
5. Ilya V. Manukhov, Daria V. Mamaeva, Sergei M. Rastorguev, Nicolai G. Faleev, Elena A. Morozova, Tatyana V. Demidkina e Gennadii B. Zavilgelsky. “Un gene che codifica L-metionina γ-liasi è presente nei genomi della famiglia delle enterobacteriaceae: identificazione e caratterizzazione della Citrobacter freundii L-metionina γ-Liasi.”The Journal of Bacteriology. 2005 Giugno; 187 (11): 3889-3893.
6. Lindberg, Frederik; Westman, Lennart; Normark, Staffan. “Regulatory Components in Citrobacter freundii ampC β-lactamase Induction.”Proceedings of the National Academy of Sciences of the United States of America. 1985 Luglio; 82 (14): 4620-4624.
7. Tsukamoto K, Tachibana K, Yamazaki N, Ishii Y, Ujiie K, Nishida N, Sawai T. ” Ruolo della lisina-67 nel sito attivo della beta-lattamasi di classe C da Citrobacter freundii GN346.”European Journal of Biochemistry / FEBS. 1990 Febbraio 22; 188 (1): 15-22.
8. Keevil CW, Hough JS, Cole JA. “Crescita prototrofica di Citrobacter freundii e la base biochimica per i suoi requisiti apparenti di crescita nei media aerati.”Journal of General Microbiology. 1997 Gennaio; 98 (1): 273-6.
9. Marco Sanchez F, Turabian Fernández JL, Durán Pérez-Navarro A. “Fatale Citrobacter Freundii broncopolmonite acquisita nella Comunità in un paziente senza compromessi.”Revista Clínica Española. 1985 Apr; 176 (6): 320
10. Il suo nome deriva da quello di una donna. “Citrobacter freundii invade e si replica nelle cellule endoteliali microvascolari del cervello umano.”Hinyokika kiyo. Acta Urologica Japonica. 1985 Luglio; 31 (7): 1159-70.
11. Drelichman V, Banda JD. “Bacteremias a causa di Citrobacter diversus e Citrobacter freundii. Incidenza, fattori di rischio ed esito clinico.”Archives of Internal Medicine. 1985 Ottobre; 145 (10): 1808-10.
12. Srinivasan V, Nam HM, Sawant AA, Headrick SI, Nguyen LT, Oliver SP. “Distribuzione di geni di resistenza alla tetraciclina e alla streptomicina e integroni di classe 1 nelle enterobatteriacee isolate da terreni agricoli da latte e non da latte.”Ecologia microbica. 2007 Agosto 15.
13. Sánchez-Céspedes J, Vila J. ” Caratterizzazione parziale del locus acrAB in due isolati clinici Citrobacter freundii.”International Journal of Antimicrobial Agents. 2007 Settembre; 30 (3): 259-63.
14. Ciğerci IH, Korcan SE, Konuk M, Oztürk S. “Confronto tra le attività ALAD dei ceppi Citrobacter e Pseudomonas e il loro utilizzo come biomarcatore per la contaminazione da Pb.”Monitoraggio e valutazione ambientale. 2007 Maggio 22.
15. Chocat P, Esaki N, Tanizawa K, Nakamura K, Tanaka H, Soda K. “Purificazione e caratterizzazione della selenocisteina beta-liasi da Citrobacter freundii.”Journal of Bacteriology. 1985 Agosto; 163 (2): 669-76.
16. Hillel S Levinson, Inga Mahler. “Attività fosfatasi e resistenza al piombo in Citrobacter freundii e Staphylococcus aureus.”FEMS Microbiology Letters. 1998 Aprile; 161 (1): 135-138.
17. Murakami K, Yoshida T. ” Legame covalente di moxalactam alla cefalosporinasi di Citrobacter freundii.”Agenti antimicrobici e chemioterapia. 1985 Maggio; 27(5): 727-32.
18. Dervisoglu, E., Yegenaga, I., Yumuk, Z. “Citrobacter Freundii peritonite e infezione del tunnel in un paziente in dialisi peritoneale ambulatoriale continua.”Journal of Medical Microbiology, 2008. Volume 57. pag. 125-127.
19. Kim PW, Harris AD, Roghmann MC, Morris JG Jr, Strinivasan A, Perencevich IT. “Fattori di rischio epidemiologici per l’isolamento di ceftriaxone-resistente versus-suscettibile citrobacter freundii in pazienti ospedalizzati” Agenti Antimicrob Chemother, 2003 Sep;47(9): p.2882-2887.
20. Nada T, Baba H, Kawamura K, Ohkura T, Torii K, Ohta M. “Un piccolo focolaio di infezione da Citrobacter freundii resistente al cefema di terza generazione in un reparto chirurgico” Jpn J Infect Dis. 2004 Agosto; 57 (4): p.181-182.
21. Chuang, Y., Tseng, S., Teng, L., Ho, Y., e Hsueh, P. “Emergence of cefotaxime resistance in Citrobactor freundii causing necrotizing fascitis and osteomielitis” Journal of Infection, 2006. Volume 53. p. e161-e163.
22.Badger, J., Stins, M. e Sik Kim, K. “Citrobacter freundii invade e replica nelle cellule endoteliali microvascolari del cervello umano” Infection and Immunity, 1999. Volume67. P. 4208-4215.
A cura di Sumaira Akbarzada, studente di Rachel Larseneditato da Greg Vargas e Darren Zhen ,studenti della M Glogowskiat Loyola Universityeditato da Gergana Grigorova e Michal Olszewski, studenti della M Glogowskiat Loyola Universityeditato da Alex Kula e Joanna Aiken, studenti della M Glogowskiat Loyola University