A Microbial Biorealm page on the genus Citrobacter freundii
Classification
Higher order taxa
Bacteria; Proteobacteria; Gammaproteobacteria; Enterobacteriales; Enterobacteriaceae; Citrobacter
Species
NCBI: Taxonomy
Citrobacter Freundii
Description and significance
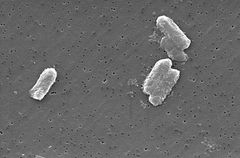 Photo: Pete Wardell / CDC
Photo: Pete Wardell / CDC
a Citrobacter fajok, köztük a Citrobacter freundii, aerob gram-negatív bacillusok. A Citrobacter freundii hosszú rúd alakú baktériumok, amelyek általában 1-5 cm hosszúak . A legtöbb C. freundii sejtet sok mozgáshoz használt flagella veszi körül, de néhány nem mozgékony. Élőhelye magában foglalja a környezetet (talaj, víz, Szennyvíz), az élelmiszereket és az állatok és az emberek bélrendszerét . Az Enterobacteriaceae családhoz tartozik.
mint opportunista kórokozó, a C. freundii számos jelentős opportunista fertőzésért felelős. Ismert, hogy a légzőrendszer, a húgyutak, a vér és számos más, általában steril hely számos nozokomiális fertőzésének oka a betegeknél . A C. freundii az összes opportunista fertőzés körülbelül 29% – át képviseli . Ezért az egyik fő oka annak, hogy a C. freundii Genom számos különböző törzsét és plazmidját szekvenálják, hogy megtalálják az antibiotikumokat, amelyek képesek leküzdeni ezeket az opportunista fertőzéseket.
meglepő módon ez a fertőző mikroba az emberekben pozitív szerepet játszik a környezetben. C. a freundii felelős a nitrát nitritté történő csökkentéséért a környezetben . Ez a kritikus átalakítás a nitrogénciklus fontos szakasza. A nitrogén újrahasznosítása nagyon fontos, mivel a Föld légköre körülbelül 85% nitrogén . Ezért a környezethez való fontos hozzájárulása miatt egy másik motiváció a C. freundii genomjának szekvenálására.
a Citrobacter nemzetséget 1932-ben fedezte fel Werkman és Gillen. A C. freundii kultúrákat ugyanabban az évben izolálták és azonosították a talajkivonatokból .
Genomszerkezet
A C. freundii teljes genomjáról nem áll rendelkezésre információ az interneten, bár a mikroba egyes törzseit és plazmidjait szekvenálták. A legjelentősebb a pCTX-M # 3 plazmid, mivel ez a legnagyobb plazmid, és nagy mennyiségű fehérjét kódol. A sorrend befejeződött január 6, 2005. Ez egy kör alakú DNS-plazmid, 89 468 nukleotid bázispár hosszú. A plazmid hossza 0,089468 (Mbp). 51,0 % GC-tartalomból áll, és 105 fehérjét kódol .
A C másik fontos jellemzője. a freundii Genom az, hogy ez az egyetlen mikroba az Enterobacteriaceae családban, amely plazmidot tartalmaz, amely kódolja az L-metionin- ++ – liázt (MGL). A plazmid nukleotidszekvenciája 3000 bp hosszú EcoRI betétet tartalmaz . A töredék két nyitott olvasókeretet is tartalmaz. Az első keret 1194 nukleotidból, a második pedig 1296 nukleotidból áll.Az első keret, az úgynevezett megL gén, 398 aminosavmaradékból álló fehérjét kódol, amelynek szekvencia homológiája van a különböző forrásokból származó MGL-ekkel. A második keret egy szekvencia homológiájú fehérjét kódol a permeázok családjába tartozó fehérjékkel .
A C. freundii OS60 AMPC-laktamáz gént szintén szekvenálták, és 1197 nukleotidból áll. 380 aminosav hosszú prekurzort kódol, és 19 maradék jel peptidet tartalmaz az 5′ végén . Ez a gén egy érett fehérjét kódol, amelynek molekulatömege 39 781 Dalton. Ezekben a prekurzorokban az aminosav-pozíciók suprisinlgy azonosak az E. coli K12 kromoszómális AmpC-ben található maradékokkal .
egy másik fontos törzs a C genomjában. a freunii GN346, amely egy 1965-ben visszanyert klinikai izolátum. Ez a törzs termeli a cefalosporináz enzimet, amely képes hidrolizálni és inaktiválni az anibitoikus cefalosporinokat és cefamicineket . A cefalosporináz gén strukturális és promoter régiói 1408 nukleotid hosszúak. Az érett enzim aminosav-szekvenciája 361 aminosavból áll, molekulatömege 39 878 Da .
sejtszerkezet és anyagcsere
A C. freundi sejtstruktúrája hosszú és rúd alakú, általában 1-5 km hosszú. A sejt külső része sok motalitáshoz használt flagellát tartalmaz . Mivel a C. freundii gram-negatív baktérium, két membránt tartalmaz (belső és külső).A periplazmás tér a két membrán között helyezkedik el. A külső membrán nem tartalmaz energiaforrást; de sok porint tartalmaz beágyazva, amelyek segítik a szervezetet fontos ionok megszerzésében . A gram-pozitív baktériumokkal ellentétben a C. freundii sejtek nem tartalmaznak vastag sejtfalat, amely peptidoglikánból áll.
az anyagcsere, C. freundii van egy csodálatos képessége, hogy növekszik a glicerin, mint az egyetlen szén-és energiaforrás. Ebben a folyamatban a glicerint diszmutációs eljárással fermentálják. Ez a folyamat két utat igényel . Az első út során a glicerint egy NAD1-hez kapcsolt glicerin-dehidrogenáz dehidrogénezi dihidroxi-acetonnal. A dihidroxi-acetont ezután foszforilálják, majd a dihidroxi-aceton-kináz glikolízissel tölcsérezi . A második út során a glicerint a B12-függő glicerin-dehidratáz dehidratálja, így 3-hidroxi-propionaldehid képződik . Ezt a terméket az 1,3-propándiol fő fermentációs termékké redukálja a NADH-hoz kapcsolt 1,3-propándiol-dehidrogenáz, amely regenerálja a NAD1-et. A DHA regulon e két út négy alapvető enzimét kódolja. Meglepő módon a DHA regulon expressziója csak akkor indukálódik, ha glicerin van jelen .
A C. freundii sejtjei szintén képesek laktózt vagy citrátot metabolizálni szénforrásként .
ökológia
a Citrobacter freundii gyakran megtalálható a környezetben, főleg a talajban, a vízben és a csatornákban. Ezek a víz potenciális szennyeződésének mutatói. A beteg állatok különböző szervein is megtalálhatók, beleértve az emlősöket, madarakat, hüllőket és kétéltűeket . Nem ismert, hogy kölcsönhatásba lépnének más szervekkel.
a környezetben a C. freundii képes nitrátot vagy ammóniumionot (amely négy hidrogénatommal kombinált nitrogénatom) nitritté alakítani; ez a reakció a környezetben, valamint az emberek és más állatok emésztőrendszerében történik . Miután a nitrátot nitritté alakítja a környezetben, a nitrit nitrogénné alakul, és ez az utolsó lépés befejezi a nitrogénciklust a Föld légkörében, amely 85% nitrogénből áll . Ennek a szervezetnek az ökológiai szerepe nemcsak a nitrogénciklusban betöltött fontos szerepét foglalja magában, mert foszfát komplexek építésével uránt is felhalmozhat (amely a nukleáris technológia alapanyaga).
a Citrobacter freundii-t a cserzőanyagokban használt csersav biológiai lebontása szempontjából is vizsgálták .
patológia
mint opportunista kórokozó, a Citrobacter freundii gyakran okoz jelentős opportunista fertőzéseket, ami azt jelenti, hogy általában nem okoz betegséget egészséges emberi gazdaszervezetekben. Csak a gyenge immunrendszerrel rendelkező betegeket érintik, jelezve, hogy “lehetőségre” van szükségük a személy megfertőzésére . Ezért az elnyomott immunrendszerrel rendelkező betegeknél a Citrobacter fajok ismert módon a légzőrendszer, a húgyúti és a vér nozokomiális fertőzéseinek széles skáláját okozzák . A máj -, epe-és hasnyálmirigy-betegségek szintén gyakori betegségek, amelyeket a C. freundii okoz. Az epeutak a C. freundii bacillusok által okozott fertőzés leggyakoribb helye .
az egyik halálos betegség, amellyel a C. freundii társult, az újszülöttkori meningitis. Az újszülött meningitis a meninges (a központi idegrendszert körülvevő membránrendszer) gyulladása a bakteriális invázió miatt . A Citrobacter meningitis halálozási aránya elfogadhatatlanul magas, a betegek halálozási aránya 25-50 %. Sőt, a túlélők 75% – ánál továbbra is fennállnak súlyos neurológiai problémák. Ebben a betegségben a Citrobacter freundii képes áthatolni a vér-agy gáton, amely a choroid plexus epitheliumból és az agyi kapilláris endotheliumból áll .
a Badger et által végzett tesztek. al a cikk “Citrobacter freundii megtámadja és replikálja az emberi agy mikrovaszkuláris endothel sejtek”arra utalnak, hogy a bakteriális proliferáció C. freundii zajlik a sejten belüli szinten, ami ellentétes volt az általános tudományos gondolat. Az eredmények azt mutatják, hogy a C. freundii áthalad a vacuolákon, replikálódik és felszabadul az emberi agy mikrovaszkuláris endothel sejtjeinek (HBMEC) bazolaterális oldalába, hogy áthaladjon a vér-agy gáton. További elemzés potenciálisan lehetővé teheti terápiás stratégiák fertőzések kezelésére. Még mindig nem áll rendelkezésre terápiás kezelés .
a pisztrángokon és ciprusokon vizsgált bizonyos betegségeket a C. freundii is okozza. A C. freundii abnormális gyulladásos változásokat okoz a pisztráng belsejében, valamint gyulladásos és nekrotikus változásokat okoz a ciprusok belső szerveiben. A betegséget mesterséges fertőzés útján fedezték fel C. freundii tiszta kultúrájával. Ez a felfedezés a C. freundii-t a halbetegség okaként hozta létre .
a Journal of Medical Microbiology esettanulmányában egy betegnél peritonitis és alagút fertőzés alakult ki a Citrobacter freundii miatt, ami nem gyakori. A beteg folyamatos ambuláns peritoneális dialízisen volt. A kiváltó anyagok általában gram-pozitív mikroorganizmusok, különösen a Staphylococcus aureus és a Staphyloccus edpidermis. Szintén nincsenek ismert jelentések alagút fertőzés miatt C. freundii. A kezdeti antibiotikum-kezelés nem működött, és a fertőzés a katéter eltávolításáig folytatódott. Ez klinikailag jelentős, mivel a Citrobacter Freundii eltérő antibiotikum-érzékenységet mutat, ezért a kezdeti terápia nem volt sikeres. A beteg nem reagált a kezelésre, amíg a katétert el nem távolították, ami azt mutatja, hogy a Citrobacter freundii opportunista kórokozók, amelyek a kórházi és immunhiányos betegeket érintik .
alkalmazás a biotechnológiára
a biotechnológiai iparban a Citrobacter freundii számos fontos enzimet termel.Az első enzim, amelyet termel, a foszfatáz. A C foszfatáz aktivitása. a freundii-t feltételezik, hogy részt vesz az ólom felhalmozásában, amely fontos szerepet játszhat a biotechnológiai iparban. Kiderült, hogy a C. freundii foszfatáz aktivitása ellenáll bizonyos diagnosztikai reagensekkel szemben .
a bakteriális szelenocisztein béta-liáz-egy enzim, amely specifikusan katalizálja az L-szelenocisztein l-alaninná történő hasítását-tisztítását és jellemzését Citrobacter freundii-ból tisztítottuk. Az enzim monomer, molekulatömege kb. 64 000, és 1 mól piridoxál-5′ – foszfátot tartalmaz kofaktorként egy mól enzimenként. Az enzim katalizálja a béta-klór-L-alanin alfa, béta eliminációját is NH3, piruvát.
C. A Freundii törzsek plazmidot is hordoznak, amely az 1. osztályú AmpC cefalosporinázt kódolja. Ezek az enzimek hidrolizye inaktiválják az új cefamicineket és cefalosporinokat .
jelenlegi kutatás
a közelmúltban a Knoxville-i Tennessee Egyetemen végeztek kis léptékű kutatást a C. freundii bizonyos törzseivel kapcsolatban. Bizonyos tetraciklin és sztreptomicin rezisztencia gének és 1. osztályú integronok jelentősége A C-ben. a tejüzemek talajából izolált freundii-t és a nem tejelő talajokat értékelték. A tejüzemek talajából kivont C. freundii egyik törzse 1. osztályú integronokat szállított különböző behelyezett génkazettákkal. Ennek a kis tanulmánynak az eredményei arra utaltak, hogy a többszörös rezisztencia gének és az 1.osztályú integronok jelenléte a C. freundii-ban a tejüzemek talajában az antimikrobiális rezisztencia gének tározójaként működhet, és szerepet játszhat ezen antimikrobiális rezisztencia gének terjesztésében a talajban lévő más kommenzális és őshonos mikrobiális közösségekben. Ennek a hipotézisnek a alátámasztásához azonban további, több helyen végzett hosszabb távú vizsgálatokra van szükség .
A C. freundii-t egy olyan polimeráz láncreakció (PCR) módszer kidolgozására végezték, amely egyidejűleg három pár specifikus primert használ bizonyos mikrobák génjeinek kimutatására (beleértve a C. freundii-t is). A módszer három alapozó pár tervezését foglalta magában: SPVC-1 és SPVC-2, INVA-1 és INVA-2; valamint VIAB-1 és VIAB-2. A PCR – t ezzel a három primerrel végeztük 14 klinikailag fontos bakteriális organizmus azonosítására. A következő törzseket gyorsan azonosították a PCR segítségével: (1) C. freundii; (2) S. Typhi; és S. Paratyphi C; (3) S. Dublin (virulencia antigén-pozitív); és (4) Salmonella szerovarok, amelyek SPV típusú virulencia plazmidot hordoznak. Bár ez a PCR-módszer új, a technológia fejlődésével a jövőben ez a módszer lehetővé teszi a C. freundii azonnali azonosítását emlősökben, így a megfelelő antibiotikum-kezelés késedelem nélkül megkezdhető .
A C. freundii-t a spanyolországi Barcelonai Egyetemen végezték. A fluorokinolonokkal szembeni rezisztencia mechanizmusait két Citrobacter freundii törzsben tanulmányoztuk. Mindkét törzset ugyanattól a betegtől izoláltuk. Ez a vizsgálat lehetővé tette a mikroorganizmus acrA és acrB génjeinek részleges jellemzését. A gének expresszióját mindkét törzsben az Escherichia coli DNS mikroarray-jével elemeztük. A C. freundii és az E. coli részlegesen szekvenált acrA és acrB génjei közötti nukleotid-hasonlóság 80,7%, illetve 85% volt. A C. freundii acrA és acrB génjei hasonlóak az e génekhez. a coli és túlzott expressziója fontos szerepet játszhat a fluorokinolonok végső minimális gátló koncentrációjának modulálásában .
A C. freundii-val kapcsolatos negyedik vizsgálatot Tajvanon végezték. Egy kutatócsoport izolált egy diabéteszes beteget, akinek nekrotizáló fasciitis alakult ki, amelyet C. freundii okozott egy tengeri állat által kiváltott sérülésből. A nekrotizáló fasciitis egy fertőzés a bőr és a bőr alatti szövetek mélyebb rétegében. A beteg kezelése során mintát vettek a sebben lévő folyadékból, és C. freundii-t találtak. A cefotaxminnal és cefepminnal végzett antibiotikus kezelés megkezdését követő három nap elteltével subcutan tályogok halmozódtak fel. 6, 10, 14 és 21 napos kezelés után néhány antibiotikum enyhülést adott a betegnek, de hosszú távú gyógyulást nem sikerült elérni. A cefotoaxim, a cefepim, a ciprofloxamin azon antibiotikumok közé tartoznak, amelyek nem egyeztek a C. freundii-val. A beteg 42 napos ertapenem-kezelés után teljesen felépült. A kutatók egymástól 5 napon belül izolálták a C. freundii két kolóniáját. Az izolátumok termesztésével rendkívül ellenállóvá váltak a cefotaximmal és a cefepimmel szemben. Az entrapenem azért működött a C. freundii ellen, mert aktív az AmpC ellen, amely Enterobacteriaceae-t termel .
antibiotikum-rezisztencia
a Citrobacter fajok a kórházi kezelésekkel járó nozokomiális fertőzések gyakori okai. A C. freundii a közelmúltban arról számolt be, hogy rezisztenciát mutat a széles spektrumú antibiotikumokkal szemben, beleértve a piperacillint, a piperacillintazobaktámot, a vankomicint és a cefalosporinokat. A ceftriaxon-rezisztens Citrobacter freundii (CRCF) izolálását összefüggésbe hozták a túlírott széles spektrumú antibiotikumokkal. A kialakuló új CRCF törzsek a rezisztencia gének indukciójára vagy depressziójára, valamint a Versengő szervezetek eliminációjára utalhatnak. A CRCF-et többnyire jelentős társbetegségben szenvedő betegekből izolálták, beleértve az AIDS-et, a perifériás érbetegséget és a cerebrovascularis betegséget. A fluorokinolon alkalmazása szintén beszámoltak arról, hogy nincs hatással a CRCF izolálására .
A Citrobacter freundii szintén ismert, hogy kromoszómájában a cefalosporinázt kódoló gént tartalmaz. Ez az enzim hidrolizálja−CO− NH-kötést a cefalosporinok és a cefamicis laktámgyűrűjében, ezáltal a baktériumokat rezisztenssé teszi az ilyen típusú antibiotikumokkal szemben. Új, harmadik generációs cefémeknek és cerbapenemeknek való kitettség esetén azonban a klinikailag izolált C. freundii érzékenységet mutatott ezekre az anyagokra.A Nagoya Egyetemi Kórház Sebészeti Osztályán műtéti eljárásokon átesett betegeknél megfigyelték a harmadik generációs cefemákkal szemben rezisztens C. freundii kis kitörését. A C. freundii izoláltuk beteg epe, seb géz, széklet, genny, ascites. Azt javasolták, hogy a C. freundii ezen új törzsei tartalmazzanak egy AmpC celphalosporinázt kódoló plazmidot, de miután a cephems rezisztenciát nem sikerült átvinni a C. freundii-ról az E. coli-ra, arra a következtetésre jutottak, hogy az enzimet a C. freundii kromoszómájába kell kódolni. Mivel a C. freundi nozokomiális fertőzésekkel jár, óvatosság ajánlott ezen új törzsekkel szemben .
1. Wang JT, Chang SC, Chen YC, Luh KT. “A Citrobacter freundii izolátumok antimikrobiális érzékenységének összehasonlítása két különböző időszakban.”A Journal of Microbiology, Immunology and Infection. 2000 Dec; 33(4): 258-62.
2. Whalen JG, Mully TW, Enlgish JC 3. “Spontán Citrobacter freundii fertőzés immunkompetens betegben.”Bőrgyógyászati archívum. 2007 január; 143(1): 124-5.
3. Puchenkova SG. “Enterobaktériumok a krími part mentén fekvő vízterületeken.”Mikrobiolohichny ^ zhurnal. 1996 Márc-Ápr; 58(2): 3-7.
4.http://www.ncbi.nlm.nih.gov/sites/entrez?db=genomeprj&cmd=Retrieve&dopt=Overview&list_uids=13123
5. Ilja V. Manukhov, Daria V. Mamaeva, Szergej M. Rastorguev, Nicolai G. Faleev, Elena A. Morozova, Tatyana V. Demidkina és Gennadii B. Zavilgelsky. “Az Enterobacteriaceae család Genomjaiban jelen van egy L-metionin (L-metionin) – liázt kódoló gén: a Citrobacter freundii (L-metionin) L-metionin (L-metionin) – liáz azonosítása és jellemzése.”A bakteriológiai folyóirat. 2005. június; 187(11): 3889-3893.
6. Lindberg, Frederik; Westman, Lennart; Normark, Staffan. “Szabályozó komponensek Citrobacter freundii ampC ++ – laktamáz indukció.”Az Amerikai Egyesült Államok Nemzeti Tudományos Akadémiájának folyóirata. 1985 július; 82(14): 4620-4624.
7. Tsukamoto K, Tachibana K, Yamazaki N, Ishii Y, Ujiie K, Nishida N, Sawai T. ” A lizin-67 szerepe a Citrobacter freundii GN346 C osztályú béta-laktamáz aktív helyén.”European Journal of Biochemistry / FEBS. 1990 február 22; 188(1): 15-22.
8. Keevil CW, Hough JS, Cole JA. “A Citrobacter freundii prototróf növekedése és a látszólagos növekedési követelmények biokémiai alapja a levegőztetett közegben.”Általános mikrobiológiai folyóirat. 1997 január; 98 (1): 273-6.
9. Marco S. A. C., Turabiai páfrány A. C., D. A. C., B. A., B., B., B., B., B., B., B., B., B., B., B., B. “Halálos Citrobacter Freundii Bronchopneumonia a közösségben egy kompromisszum nélküli betegben szerzett.”Revista Cl). 1985 április; 176 (6): 320
10. Julie L. Badger, Monique F. Stins és Kwang Sik Kim. “A Citrobacter freundii behatol és replikálódik az emberi agy mikrovaszkuláris endothel sejtjeibe.”Hinyokika kiyo. Acta Urologica Japonica. 1985 július; 31(7): 1159-70.
11. Drelichman V, zenekar JD. “Bacteremias miatt Citrobacter diversus és Citrobacter freundii. Incidencia, kockázati tényezők és klinikai kimenetel.”Belgyógyászati archívum. 1985 október; 145 (10): 1808-10.
12. Srinivasan V, Nam HM, Sawant AA, Headrick SI, Nguyen LT, Oliver SP. “A tetraciklin és sztreptomicin rezisztencia gének és az 1. osztályú Integronok eloszlása az Enterobacteriaceae-ben, tejelő és nem tejelő mezőgazdasági talajból izolálva.”Mikrobiális Ökológia. 2007 augusztus 15.
13. S) ” az acrAB lokusz részleges jellemzése két Citrobacter freundii klinikai izolátumban.”International Journal of antimikrobiális szerek. 2007 szeptember; 30(3): 259-63.
14. Ci xxiierci IH, Korcan SE, Konuk M, Ozt XXIII RK S. “A Citrobacter és a Pseudomonas törzsek ALAD aktivitásának összehasonlítása és a PB-szennyeződés biomarkerként történő felhasználása.”Környezeti Monitoring és értékelés. 2007 május 22.
15. Chocat P, Esaki N, Tanizawa K, Nakamura K, Tanaka H, Soda K. ” a Citrobacter freundii szelenocisztein béta-liázának tisztítása és jellemzése.”Bakteriológiai folyóirat. 1985 augusztus; 163 (2): 669-76.
16. Hillel S Levinson, Inga Mahler. “Foszfatáz aktivitás és ólomrezisztencia Citrobacter freundii-ban és Staphylococcus aureus-ban.”FEMS mikrobiológiai levelek. 1998 április; 161(1): 135-138.
17. Murakami K, Yoshida T. ” A moxalaktam kovalens kötődése a Citrobacter freundii cefalosporinázához.”Antimikrobiális szerek és kemoterápia. 1985 május; 27(5): 727-32.
18. Dervisoglu, E., Yegenaga, I., Yumuk, Z. ” Citrobacter Freundii peritonitis és alagút fertőzés folyamatos ambuláns peritoneális dialízisben szenvedő betegben.”Orvosi Mikrobiológiai folyóirat, 2008. 57. kötet. p. 125-127.
19. Kim PW, Harris AD, Roghmann MC, Morris JG Jr, Strinivasan A, Perencevich EN. “Epidemiológiai kockázati tényezők a ceftriaxon-rezisztens versus-fogékony citrobacter freundii izolálásához kórházi betegeknél” Antimicrob szerek Chemother, 2003 szeptember;47(9): p.2882-2887.
20. Nada T, Baba H, Kawamura K, Ohkura T, Torii K, Ohta M. “a harmadik generációs cephem-rezisztens Citrobacter freundii fertőzés kis kitörése műtéti osztályon” Jpn J fertőz Dis. 2004 augusztus;57(4): p.181-182.
21. Chuang, Y., Tseng, S., Teng, L., Ho, Y. és Hsueh, P. “Megjelenése cefotaxim rezisztencia Citrobactor freundii okozó nekrotizáló fasciitis és osteomyelitis” Journal of Infection, 2006. 53. kötet. o. e161-e163.
22.Badger, J., Stins, M. és Sik Kim, K. “A Citrobacter freundii megtámadja és replikálja az emberi agy mikrovaszkuláris Endothelsejtjeit” fertőzés és immunitás, 1999. Kötet67. P. 4208-4215.
szerkesztette Sumaira Akbarzada, Rachel Larsen hallgatójaszerkesztette: Greg Vargas és Darren Zhen, az M Glogowskiat Loyola Egyetem hallgatóiszerkesztette: Gergana Grigorova és Michal Olszewski, az M Glogowskiat Loyola Egyetem hallgatóiszerkesztette: Alex Kula és Joanna Aiken, az M Glogowskiat Loyola Egyetem hallgatóiszerkesztette: