V roce 1852, práce s William Thomson (kdo by později se stal Lord Kelvin), Joule provedl experiment, ve kterém se čerpá plyn stabilním tempem přes trubku, která byla připoutal k vytvoření stavby. Na protilehlé straně zúžení byl plyn pod vyšším tlakem než na protilehlé straně zúžení. Také teplota plynu byla pečlivě sledována na obou stranách konstrukce. Chlazení, které pozorovali, když plyn expandoval z vysokotlaké oblasti do oblasti s nižším tlakem, bylo nesmírně důležité a vedlo ke společnému designu moderních chladniček.
ne všechny plyny podléhají chladícímu účinku při expanzi. Některé plyny, jako je vodík a helium, zažijí oteplovací účinek při expanzi za podmínek blízkých pokojové teplotě a tlaku. Směr změny teploty lze určit měřením Joule-Thomsonova koeficientu, \(\mu_{JT}\). Tento koeficient je definován tak,
\
Schematicky, Joule-Thomson koeficient může být měřena měřením poklesu teploty nebo zvýšení plynu prochází pro daný pokles tlaku (viz Obrázek \(\PageIndex{1}\)). Zařízení je izolováno tak, aby nemohlo být přenášeno žádné teplo dovnitř ani ven, takže expanze je isenthalpická.
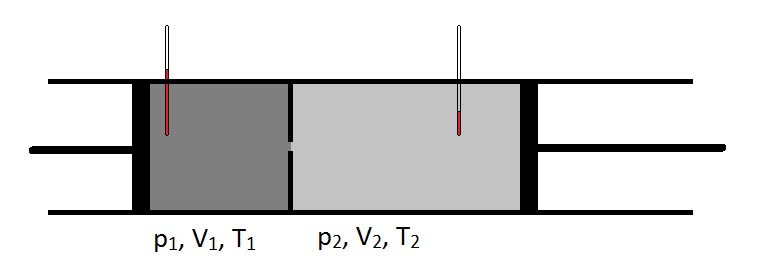
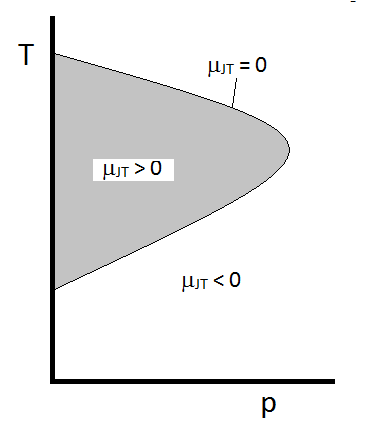
typické chování Joule-Thomson koeficient může být shrnut na Obrázku \(\PageIndex{2}\). Při kombinacích \(T\) a \(p\), pro které \(\mu_{JT} > 0\) (uvnitř stínované oblasti) se vzorek po expanzi ochladí. Na ty \(p\) a \(T\) podmínky mimo zastíněné oblasti, kde \(\mu_{JT} < 0\), plyn projde zvýšení teploty při expanzi. A podél hranice, plyn podstoupí ani zvýšení teploty neklesne při expanzi. Pro daný tlak jsou obvykle dvě teploty, při kterých \(\mu_{JT}\) mění znaménko. Jedná se o horní a dolní inverzní teploty.
Pomocí nástrojů matematiky, je možné vyjádřit Joule-Thomson koeficient z hlediska měřitelných vlastností. Zvažte entalpii jako funkci tlaku a teploty: \(H(p, T)\). To naznačuje, že totální diferenciál \(dH\) může být vyjádřena
\
bude ukázáno později (opět, jakmile budeme rozvíjet Maxwell Vztahy), že
\
jednoduché substituce ukazuje,
\
\
Pro ideální plyn, \(\alpha = 1/T\), takže
\
která způsobí, že první termín zmizí. Takže pro konstantní expanzi entalpie (\(dH = 0\)) nemůže dojít ke změně teploty (\(dT = 0\)). To znamená, že plyny budou vykazovat nenulové hodnoty pro \(\mu_{JT}\) pouze proto, že se odchylují od ideálního chování!
příklad \(\PageIndex{1}\):
Odvoďte výraz pro \(\mu_{JT}\) v oblasti \(\alpha\), \(C_p\), \(V\) a \(T\).
Řešení
Pomocí totální diferenciál pro \(H(p, T)\) (Rovnice \ref{totalH}):
\
Dělení \(dp\) a omezení na konstantní \(H\):
\
Zmínku, že
\
\
a
\
\
pak můžeme použít následující substituce:
\
\
\
\
A řešení pro \(\mu_{JT}\) dává
\
Přispěvatelé a Pravomocí
-
Patrick E. Fleming (Katedra chemie a biochemie; California State University, East Bay)