En 1852, en collaboration avec William Thomson (qui deviendra plus tard Lord Kelvin), Joule a mené une expérience dans laquelle ils pompaient du gaz à une vitesse constante à travers un tuyau en plomb qui était attaché pour créer une construction. Du côté amont de la constriction, le gaz était à une pression plus élevée que du côté aval de la constriction. De plus, la température du gaz a été soigneusement surveillée de chaque côté de la construction. Le refroidissement qu’ils ont observé lorsque le gaz passait d’une région à haute pression à une région à basse pression était extrêmement important et a conduit à une conception commune des réfrigérateurs modernes.
Tous les gaz ne subissent pas un effet de refroidissement lors de la détente. Certains gaz, tels que l’hydrogène et l’hélium, subiront un effet de réchauffement lors de l’expansion dans des conditions proches de la température et de la pression ambiantes. La direction du changement de température peut être déterminée en mesurant le coefficient Joule-Thomson, \(\mu_{JT}\). Ce coefficient a la définition
\
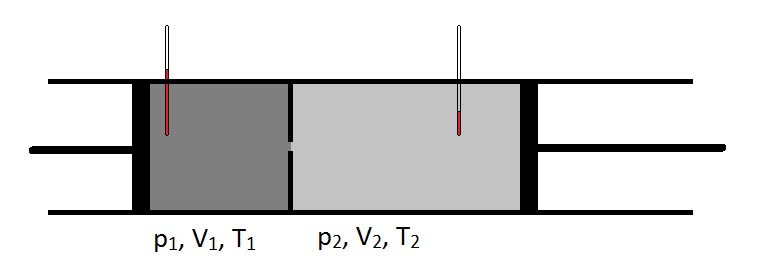
Schématiquement, le coefficient Joule-Thomson peut être mesuré en mesurant la chute de température ou l’augmentation subie par un gaz pour une chute de pression donnée (Figure\(\PageIndex{1}\)). L’appareil est isolé de sorte qu’aucune chaleur ne puisse être transférée à l’intérieur ou à l’extérieur, ce qui rend l’expansion isenthalpique.
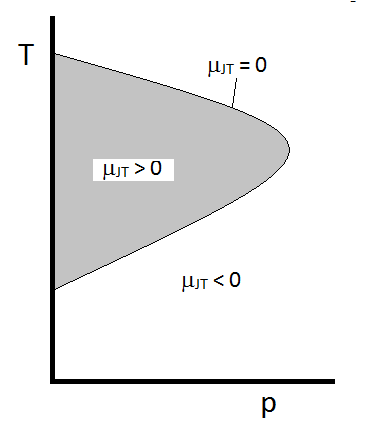
Le comportement typique du coefficient Joule-Thomson peut être résumé dans Figure\(\PageIndex{2 }\). Aux combinaisons de \(T\) et \(p\) pour lesquelles \(\mu_{JT} > 0\) (à l’intérieur de la région ombrée), l’échantillon se refroidira lors de l’expansion. Dans ces conditions \(p\) et \(T\) en dehors de la région ombragée, où \(\mu_{JT} < 0\), le gaz subira une augmentation de température lors de l’expansion. Et le long de la limite, un gaz ne subira ni une augmentation de température ni une diminution lors de l’expansion. Pour une pression donnée, il y a typiquement deux températures auxquelles \(\mu_{JT}\) change de signe. Ce sont les températures d’inversion supérieure et inférieure.
En utilisant les outils des mathématiques, il est possible d’exprimer le coefficient Joule-Thomson en termes de propriétés mesurables. Considérez l’enthalpie en fonction de la pression et de la température: \(H(p, T) \). Ceci suggère que le différentiel total \(dH\) peut être exprimé
\
Il sera montré plus tard (encore une fois, une fois que nous aurons développé les relations de Maxwell) que
\
Une substitution simple montre
\
So
\
Pour un gaz idéal, \(\alpha=1/T\), donc
\
ce qui fait disparaître le premier terme. Ainsi, pour une expansion d’enthalpie constante (\(dH = 0\)), il ne peut y avoir de changement de température (\(dT = 0\)). Cela signifie que les gaz n’afficheront que des valeurs non nulles pour \(\mu_{JT}\) uniquement parce qu’ils s’écartent du comportement idéal!
Exemple \(\PageIndex{1}\):
Dérivez une expression pour \(\mu_{JT}\) en termes de \(\alpha\), \(C_p\), \(V\) et \(T\).
Solution
En utilisant la différentielle totale pour \(H(p, t)\) (Équation \ref{totalH}):
\
En divisant par \(dp\) et en contraignant à la constante \(H\):
\
En notant que
\
\
et
\
donc
\
Nous pouvons alors utiliser les substitutions suivantes:
\
\
\
Pour obtenir
\
Et la résolution de \(\mu_{JT}\) donne
\
Contributeurs et attributions
-
Patrick E. Fleming (Département de chimie et de biochimie; Université d’État de Californie, East Bay)