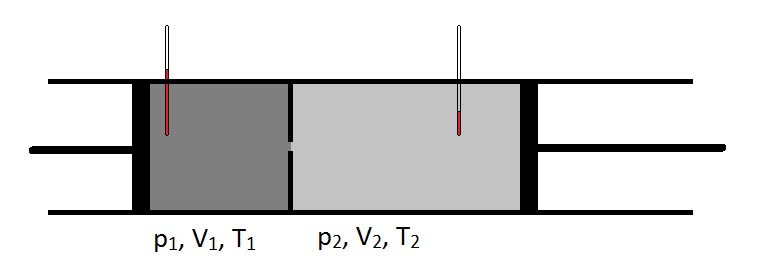
1852 führte Joule in Zusammenarbeit mit William Thomson (der später Lord Kelvin werden sollte) ein Experiment durch, bei dem sie Gas mit konstanter Geschwindigkeit durch ein Bleirohr pumpten, das zu einer Konstruktion zusammengefügt wurde. Auf der stromaufwärtigen Seite der Einschnürung stand das Gas unter einem höheren Druck als auf der stromabwärtigen Seite der Einschnürung. Außerdem wurde die Temperatur des Gases auf beiden Seiten der Konstruktion sorgfältig überwacht. Die Kühlung, die sie beobachteten, als sich das Gas von einem Hochdruckbereich in einen Niederdruckbereich ausdehnte, war äußerst wichtig und führte zu einem gemeinsamen Design moderner Kühlschränke.
Nicht alle Gase haben bei der Expansion einen Kühleffekt. Einige Gase, wie Wasserstoff und Helium, erfahren einen Erwärmungseffekt bei der Expansion unter Bedingungen nahe Raumtemperatur und Druck. Die Richtung der Temperaturänderung kann durch Messung des Joule-Thomson-Koeffizienten \(\mu_{JT}\) bestimmt werden. Dieser Koeffizient hat die Definition
\
Schematisch kann der Joule-Thomson-Koeffizient gemessen werden, indem der Temperaturabfall gemessen oder ein Gasdruck für einen gegebenen Druckabfall erhöht wird (Abbildung \(\pageIndex{1}\)). Die Vorrichtung ist isoliert, so dass keine Wärme in oder aus übertragen werden kann, so dass die Expansion isenthalpic.
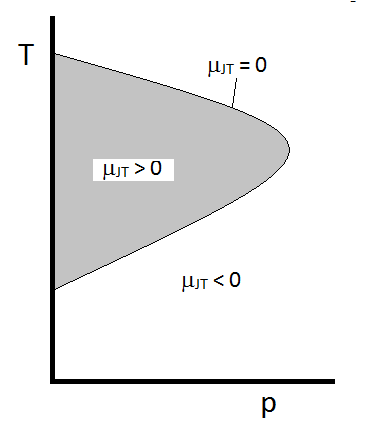
Das typische Verhalten des Joule-Thomson-Koeffizienten lässt sich in Abbildung \(\pageIndex{2}\) zusammenfassen. Bei den Kombinationen von \(T\) und \(p\), für die \(\mu_{JT} > 0\) (innerhalb des schattierten Bereichs) gilt, kühlt die Probe beim Ausdehnen ab. Bei diesen \(p\) und \(T\) Bedingungen außerhalb des schattierten Bereichs, wo \(\mu_{JT} < 0\), wird das Gas bei der Expansion eine Temperaturerhöhung erfahren. Und entlang der Grenze erfährt ein Gas bei der Expansion weder einen Temperaturanstieg noch eine Abnahme. Für einen gegebenen Druck gibt es typischerweise zwei Temperaturen, bei denen \(\mu_{JT}\) das Vorzeichen ändert. Dies sind die oberen und unteren Inversionstemperaturen.
Mit den Werkzeugen der Mathematik ist es möglich, den Joule-Thomson-Koeffizienten in messbaren Eigenschaften auszudrücken. Betrachten Sie die Enthalpie als Funktion von Druck und Temperatur: \(H(p, T)\). Dies deutet darauf hin, dass das Gesamtdifferential \(dH\) ausgedrückt werden kann
\
Es wird später gezeigt (wieder, wenn wir die Maxwell-Beziehungen entwickeln), dass
\
Eine einfache Substitution zeigt
\
Also
\
Für ein ideales Gas, \(\alpha = 1/T\), also
\
wodurch der erste Term verschwindet. Bei konstanter Enthalpieausdehnung (\(dH = 0\)) kann es also keine Temperaturänderung geben (\(dT = 0\)). Dies bedeutet, dass Gase nur dann Werte ungleich Null für \(\mu_{JT}\) anzeigen, wenn sie vom idealen Verhalten abweichen!
Beispiel \(\pageIndex{1}\):
Leitet einen Ausdruck für \(\mu_{JT}\) in Form von \(\alpha\), \(C_p\), \(V\) und \(T\) ab.
Lösung
Verwendung des Gesamtdifferentials für \(H(p, T)\) (Gleichung \ref{totalH}):
\
Dividieren durch \(dp\) und Beschränken auf die Konstante \(H\):
\
Beachten Sie, dass
\
\
also
\
Wir können dann die folgenden Substitutionen verwenden:
\
\
\
Um
\
zu erhaltenUnd nach \(\mu_{JT}\) zu lösen, ergibt
\
Patrick E. Fleming (Institut für Chemie und Biochemie; California State University, East Bay)