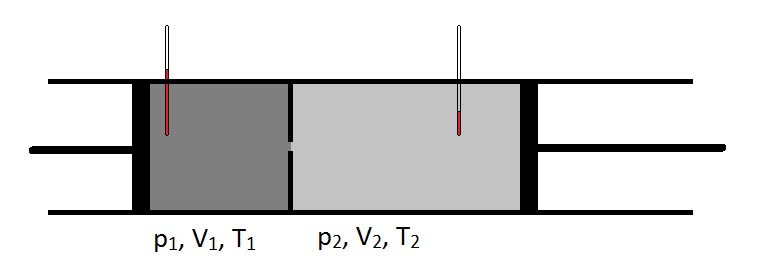
în 1852, lucrând cu William Thomson (care va deveni mai târziu Lord Kelvin), Joule a efectuat un experiment în care au pompat gazul într-un ritm constant printr-o conductă de plumb care a fost cinched pentru a crea o construcție. Pe partea din amonte a constricției, gazul se afla la o presiune mai mare decât pe partea din aval a constricției. De asemenea, temperatura gazului a fost monitorizată cu atenție pe ambele părți ale construcției. Răcirea pe care au observat-o pe măsură ce gazul s-a extins de la o regiune de înaltă presiune la o regiune de presiune mai mică a fost extrem de importantă și a dus la un design comun al frigiderelor moderne.
nu toate gazele suferă un efect de răcire la expansiune. Unele gaze, cum ar fi hidrogenul și heliul, vor experimenta un efect de încălzire la expansiune în condiții apropiate de temperatura și presiunea camerei. Direcția schimbării temperaturii poate fi determinată prin măsurarea coeficientului Joule-Thomson, \(\mu_{JT}\). Acest coeficient are definiția
\
schematic, coeficientul Joule-Thomson poate fi măsurat prin măsurarea scăderii de temperatură sau a creșterii pe care o suferă un gaz pentru o scădere de presiune dată (figura \(\PageIndex{1}\)). Aparatul este izolat astfel încât să nu se poată transfera căldură în interior sau în exterior, ceea ce face ca expansiunea să fie izentalpică.
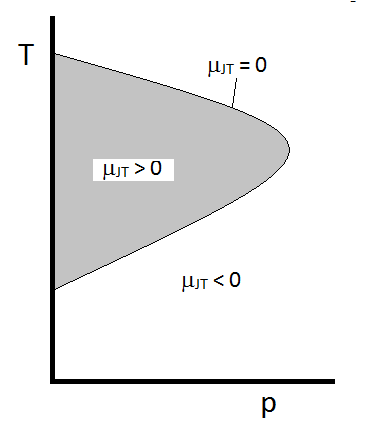
comportamentul tipic al coeficientului Joule-Thomson poate fi rezumat în figura \(\PageIndex{2}\). La combinațiile de \(T\) și \(p\) pentru care \(\mu_{JT} > 0\) (în interiorul regiunii umbrite), eșantionul se va răci la expansiune. În acele condiții \(p\) și \(T\) în afara regiunii umbrite, unde \(\mu_{JT} < 0\), gazul va suferi o creștere a temperaturii la expansiune. Și de-a lungul graniței, un gaz nu va suferi nici o creștere a temperaturii, nici o scădere la expansiune. Pentru o presiune dată, există de obicei două temperaturi la care \(\mu_{JT}\) se schimbă semn. Acestea sunt temperaturile de inversiune superioare și inferioare.
folosind instrumentele matematicii, este posibil să se exprime coeficientul Joule-Thomson în termeni de proprietăți măsurabile. Luați în considerare entalpia în funcție de presiune și temperatură: \(H(p, T)\). Acest lucru sugerează că diferența totală \(dH\) poate fi exprimată
\
se va arăta mai târziu (din nou, odată ce vom dezvolta relațiile Maxwell) că
\
o substituție simplă arată
\
deci
\
pentru un gaz ideal, \(\alpha = 1/T\), deci
\
ceea ce face ca primul termen să dispară. Deci, pentru expansiunea constantă a entalpiei (\(dH = 0\)), nu poate exista nicio modificare a temperaturii (\(dT = 0\)). Aceasta va însemna că gazele vor afișa valori diferite de zero pentru \(\mu_{JT}\) numai pentru că se abat de la comportamentul ideal!
exemplu \(\PageIndex{1}\):
derivă o expresie pentru \(\mu_{JT}\) în termeni de \(\alpha\), \(c_p\), \(V\), și \(T\).
soluție
folosind diferențialul total pentru \(H(p, T)\) (ecuația \ref{totalH}):
\
împărțirea la \(dp\) și constrângerea la constantă \(H\):
\
notând că
\
și
\
deci
\
putem folosi apoi următoarele substituții:
\
pentru a obține
\
și rezolvarea pentru\(\mu_{JT}\) dă
\
contribuitori și atribuții
-
Patrick E. Fleming (Departamentul de Chimie și Biochimie; Universitatea de Stat din California, East Bay)