I 1852, i samarbeid Med William Thomson (som senere skulle Bli Lord Kelvin), gjennomførte Joule et eksperiment der de pumpet gass i jevn hastighet gjennom et blyrør som ble cinched for å skape en konstruksjon. På oppstrømssiden av innsnevringen var gassen ved et høyere trykk enn på nedstrømssiden av innsnevringen. Også temperaturen på gassen ble nøye overvåket på hver side av konstruksjonen. Kjølingen som de observerte da gassen utvidet seg fra et høytrykksområde til et lavere trykkområde, var ekstremt viktig og førte til en felles design av moderne kjøleskap.
Ikke alle gasser gjennomgår en kjøleeffekt ved ekspansjon. Noen gasser, som hydrogen og helium, vil oppleve en oppvarmende effekt ved ekspansjon under forhold nær romtemperatur og trykk. Retningen av temperaturendringen kan bestemmes ved å måle joule-Thomson-koeffisienten, \(\mu_{JT}\). Denne koeffisienten har definisjonen
\
Skjematisk Kan joule-Thomson-koeffisienten måles ved å måle temperaturfallet eller øke en gass gjennomgår for et gitt trykkfall(Figur \(\PageIndex{1}\)). Apparatet er isolert slik at ingen varme kan overføres inn eller ut, noe som gjør utvidelsen isenthalpic.
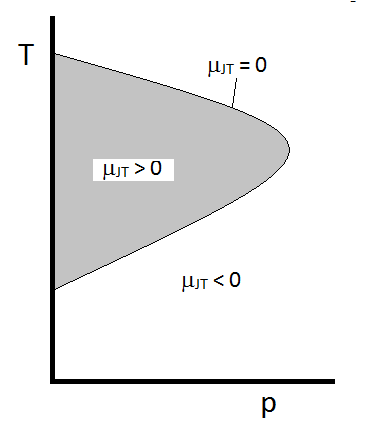
den typiske oppførselen Til joule-Thomson-koeffisienten kan oppsummeres I Figur \(\PageIndex{2}\). Ved kombinasjonene av \(T\) og\ (p\) som \ (\mu_{JT} > 0\) (inne i det skyggefulle området), vil prøven avkjøles ved utvidelse. Ved de \(p\) og\ (T\) forholdene utenfor det skyggefulle området, hvor \(\mu_{JT} < 0\) vil gassen gjennomgå en temperaturøkning ved ekspansjon. Og langs grensen vil en gass ikke gjennomgå en temperaturøkning som ikke reduseres ved ekspansjon. For et gitt trykk er det vanligvis to temperaturer der \(\mu_{JT}\) endrer tegn. Dette er øvre og nedre inversjonstemperaturer.
Ved hjelp av matematikkens verktøy er Det mulig å uttrykke joule-Thomson-koeffisienten når det gjelder målbare egenskaper. Betrakt entalpi som en funksjon av trykk og temperatur: \(H(p, T)\). Dette antyder at den totale differensialen \(dH\) kan uttrykkes
\
Det vil bli vist senere (igjen, når Vi utvikler Maxwell-Relasjonene) at
For en ideell gass,\(\alpha = 1/T\), så
\
som fører til at den første termen forsvinner. Så for konstant entalpi ekspansjon (\(dH = 0\)), kan det ikke være noen endring i temperatur (\(dT = 0\)). Dette vil bety at gasser bare viser ikke-nullverdier for \(\mu_{JT}\) bare fordi de avviker fra ideell oppførsel!
Eksempel \(\PageIndex{1}\):
Utlede et uttrykk for \(\mu_{JT}\) i form av \(\alpha\), \(C_p\), \(V\), og \ (T\).
Løsning
Ved hjelp av total differensial for \(H(p, T)\) (Ligning \ref{totalH}):
\
Dividere med \(dp\) Og begrense til konstant \(H\):
og
så
\
vi kan Da Bruke følgende substitusjoner:
\
\
for å få
\
og løse for\(\mu_{jt}\) gir
\
bidragsytere og attribusjoner
-
patrick e. Fleming (Institutt For Kjemi Og Biokjemi; California State University, East Bay)