1852, i samarbete med William Thomson (som senare skulle bli Lord Kelvin), genomförde Joule ett experiment där de pumpade gas i jämn takt genom ett blyrör som cinched för att skapa en konstruktion. På uppströmssidan av förträngningen var gasen vid ett högre tryck än på nedströmssidan av förträngningen. Dessutom övervakades gasens temperatur noggrant på vardera sidan av konstruktionen. Kylningen som de observerade när gasen expanderade från en högtrycksregion till en lägre tryckregion var extremt viktig och ledde till en gemensam design av moderna kylskåp.
inte alla gaser genomgår en kylningseffekt vid expansion. Vissa gaser, såsom väte och helium, kommer att uppleva en uppvärmningseffekt vid expansion under förhållanden nära rumstemperatur och tryck. Temperaturförändringens riktning kan bestämmas genom att mäta joule-Thomson-koefficienten, \(\mu_{JT}\). Denna koefficient har definitionen
\
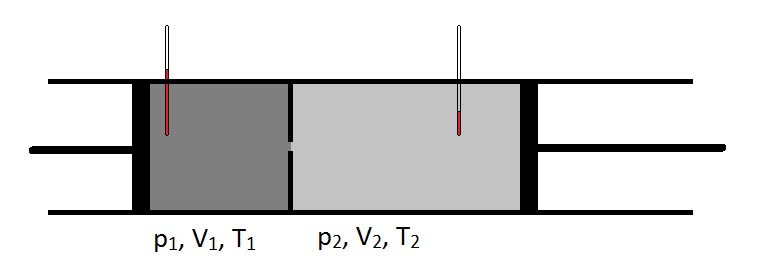
schematiskt kan joule-Thomson-koefficienten mätas genom att mäta temperaturfallet eller öka en gas genomgår för ett givet tryckfall (figur \(\PageIndex{1}\)). Apparaten är isolerad så att ingen värme kan överföras in eller ut, vilket gör expansionen isentalpisk.
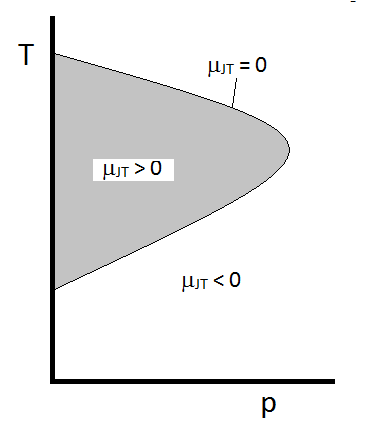
det typiska beteendet hos joule-Thomson-koefficienten kan sammanfattas i Figur \(\PageIndex{2}\). Vid kombinationerna av \(T\) och \(p\) för vilka \(\mu_{JT} > 0\) (inuti det skuggade området) kommer provet att svalna vid expansion. Vid dessa \(p\) och \(T\) förhållanden utanför det skuggade området, där \(\mu_{JT} < 0\), kommer gasen att genomgå en temperaturökning vid expansion. Och längs gränsen, en gas kommer att genomgå varken en temperaturökning inte minska vid expansion. För ett givet tryck finns det vanligtvis två temperaturer vid vilka \(\mu_{JT}\) ändrar tecken. Dessa är de övre och nedre inversionstemperaturerna.
med hjälp av matematikens verktyg är det möjligt att uttrycka joule-Thomson-koefficienten i termer av mätbara egenskaper. Betrakta entalpi som en funktion av tryck och temperatur: \(H(p, T)\). Detta tyder på att den totala skillnaden \(dH\) kan uttryckas
\
det kommer att visas senare (igen, när vi utvecklar Maxwell-relationerna) att
\
en enkel substitution visar
\
så
\
för en idealisk gas, \(\alpha = 1/T\), så
\
vilket gör att den första termen försvinner. Så för konstant entalpiutvidgning (\(dH = 0\)) kan det inte ske någon temperaturförändring (\(dT = 0\)). Detta innebär att gaser endast visar icke-nollvärden för \(\mu_{JT}\) bara för att de avviker från idealiskt beteende!
exempel \(\PageIndex{1}\):
härleda ett uttryck för \(\mu_{JT}\) i termer av \(\alpha\),\ (C_p\),\ (V\) och\(T\).
lösning
använda den totala differentialen för \(H(p, T)\) (ekvation \ref{totalH}):
\
dividera med \(dp\) och begränsa till konstant \(H\):
\
notera att
\
\
och
\
så
\
vi kan sedan använda följande substitutioner:
\
\
för att få
\
och lösa för\(\mu_{jt}\) ger
\
bidragsgivare och attribut
-
Patrick E. Fleming (Institutionen för Kemi och biokemi; California State University, East Bay)