in 1852 voerde Joule samen met William Thomson (die later Lord Kelvin zou worden) een experiment uit waarbij ze gas met een constante snelheid pompten door een loden pijp die werd geknepen om een constructie te creëren. Aan de stroomopwaartse kant van de vernauwing stond het gas onder een hogere druk dan aan de stroomafwaartse kant van de vernauwing. Ook werd de temperatuur van het gas zorgvuldig gecontroleerd aan weerszijden van de constructie. De koeling die zij waarnamen toen het gas zich uitbreidde van een hogedrukgebied naar een lagere drukgebied was uiterst belangrijk en leidde tot een gemeenschappelijk ontwerp van moderne koelkasten.
niet alle gassen ondergaan een koelend effect bij uitzetting. Sommige gassen, zoals waterstof en helium, zullen een opwarmend effect ervaren bij expansie onder omstandigheden in de buurt van kamertemperatuur en druk. De richting van de temperatuurverandering kan worden bepaald door de Joule-Thomson coëfficiënt te meten, \(\mu_{JT}\). Deze coëfficiënt heeft de definitie
\
schematisch kan de Joule-Thomson-coëfficiënt worden gemeten door het meten van de temperatuurdaling of-toename die een gas ondergaat voor een bepaalde drukval (figuur \(\Paginindex{1}\)). Het apparaat is geïsoleerd zodat er geen warmte kan worden overgedragen in of uit, waardoor de uitbreiding isenthalpic.
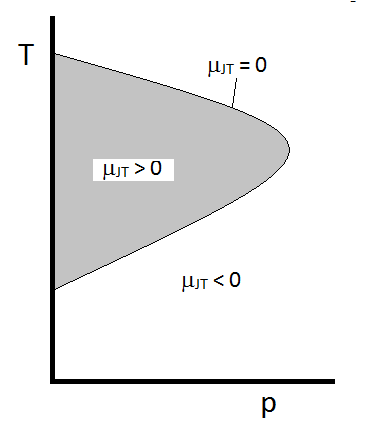
het typische gedrag van de Joule-Thomson-coëfficiënt kan worden samengevat in Figuur \(\Paginindex{2}\). Bij de combinaties van \(T\) en \(p\) waarvoor \(\mu_{JT} > 0\) (binnen het gearceerde gebied), zal het monster afkoelen bij uitbreiding. Bij die \(p\) en \(T\) omstandigheden buiten het gearceerde gebied, waar \(\mu_{JT} < 0\), zal het gas een temperatuurstijging ondergaan bij expansie. En langs de grens, zal een gas ondergaan noch een temperatuurstijging niet afnemen bij expansie. Voor een gegeven druk zijn er meestal twee temperaturen waarbij \(\mu_{JT}\) van teken verandert. Dit zijn de bovenste en onderste inversietemperaturen.
met behulp van de wiskundige instrumenten is het mogelijk om de Joule-Thomson-coëfficiënt uit te drukken in termen van meetbare eigenschappen. Beschouw enthalpie als een functie van druk en temperatuur: \(H (p, T)\). Dit suggereert dat het totale verschil \(dH\) kan worden uitgedrukt
\
Het zal later worden getoond (opnieuw, zodra we de Maxwell relaties ontwikkelen) dat
een eenvoudige substitutie
\
so
\
voor een ideaal gas,\(\alpha = 1/T\), so
\
waardoor de eerste term verdwijnt. Dus voor constante enthalpie expansie (\(dH = 0\)), kan er geen verandering in temperatuur zijn (\(dT = 0\)). Dit betekent dat gassen alleen niet-nulwaarden voor \(\mu_{JT}\) tonen omdat ze afwijken van ideaal gedrag!
voorbeeld \(\Paginindex{1}\):
leid een uitdrukking af voor \(\mu_{JT}\) in termen van \(\alpha\), \(C_p\), \(V\) en \(T\).
Oplossing
met Behulp van de totale differentiële voor \(H(p, T)\) (Vergelijking \ref{totalH}):
\
Delen door \dp\) en beperkend constante \(H\):
\
op te Merken dat
\
\
en
\
dus
\
We kunnen dan de volgende vervangingen:
\
\
\
Voor
\
En het oplossen van \(\mu_{JT}\) geeft
\
Medewerkers en Attributies
-
Patrick E. Fleming (Department of Chemistry and Biochemistry; California State University, East Bay)