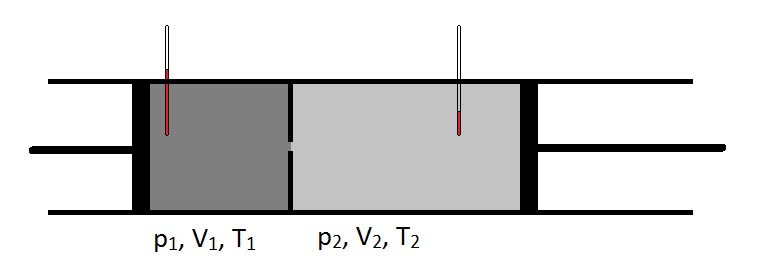
Nel 1852, lavorando con William Thomson (che sarebbe poi diventato Lord Kelvin), Joule condusse un esperimento in cui pomparono gas a una velocità costante attraverso un tubo di piombo che fu cinched per creare una costruzione. Sul lato a monte della costrizione, il gas era ad una pressione maggiore rispetto al lato a valle della costrizione. Inoltre, la temperatura del gas è stata attentamente monitorata su entrambi i lati della costruzione. Il raffreddamento che hanno osservato mentre il gas si espandeva da una regione ad alta pressione a una regione a pressione inferiore è stato estremamente importante e ha portato a un design comune dei frigoriferi moderni.
Non tutti i gas subiscono un effetto di raffreddamento in caso di espansione. Alcuni gas, come l’idrogeno e l’elio, sperimenteranno un effetto di riscaldamento all’espansione in condizioni vicine alla temperatura e alla pressione ambiente. La direzione della variazione di temperatura può essere determinata misurando il coefficiente Joule-Thomson, \(\mu_ {JT}\). Questo coefficiente ha la definizione
\
Schematicamente, il coefficiente Joule-Thomson può essere misurato misurando la caduta di temperatura o l’aumento di un gas subisce per una data caduta di pressione (Figura \(\PageIndex{1}\)). L’apparecchio è isolato in modo che nessun calore può essere trasferito dentro o fuori, rendendo l’espansione isenthalpic.
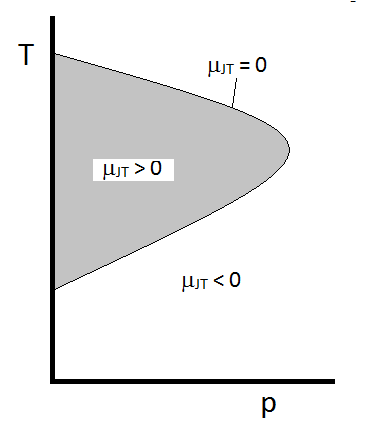
Il comportamento tipico di Joule-Thomson coefficiente possono essere riassunti in Figura \(\PageIndex{2}\). Alle combinazioni di \(T\) e \(p\) per cui \(\mu_ {JT} > 0\) (all’interno della regione ombreggiata), il campione si raffredderà all’espansione. A quelle condizioni \(p\) e \(T\) al di fuori della regione ombreggiata, dove \(\mu_{JT} < 0\), il gas subirà un aumento di temperatura all’espansione. E lungo il confine, un gas subirà né un aumento di temperatura non diminuire in caso di espansione. Per una data pressione, ci sono in genere due temperature a cui\ (\mu_{JT}\) cambia segno. Queste sono le temperature di inversione superiore e inferiore.
Utilizzando gli strumenti della matematica, è possibile esprimere il coefficiente Joule-Thomson in termini di proprietà misurabili. Considerare l’entalpia in funzione della pressione e della temperatura: \(H(p, T)\). Questo suggerisce che il totale differenziale di \(n\) può essere espresso
\
sarà illustrato più avanti (di nuovo, una volta che si sviluppano le Relazioni di Maxwell) che
\
Un semplice sostituzione spettacoli
\
\
Per un gas ideale, \(\alpha = 1/T\), e quindi
\
che provoca il primo termine a svanire. Quindi, per l’espansione entalpica costante (\(dH = 0\)), non ci può essere alcun cambiamento di temperatura (\(dT = 0\)). Ciò significa che i gas mostreranno solo valori diversi da zero per \(\mu_{JT}\) solo perché si discostano dal comportamento ideale!
Esempio \(\PageIndex{1}\):
Deriva un’espressione per \(\mu_{JT}\) in termini di \(\alpha\), \(C_p\), \(V\) e \(T\).
Soluzione
l’Utilizzo totale del differenziale per \(H(p, T)\) (Equazione \ref{totalH}):
\
Dividere per \(s\) e a limitare il costante \(H\):
\
Notare che
\
\
e
\
\
E ‘ possibile, quindi, utilizzare le seguenti sostituzioni:
\
\
\
get
\
E la risoluzione dei problemi per \(\mu_{JT}\) dà
\
Collaboratori e Attribuzioni
-
Patrick E. Fleming (Dipartimento di Chimica e Biochimica; California State University, East Bay)