vuonna 1852, työskennellen William Thomsonin (josta myöhemmin tuli lordi Kelvin) kanssa, Joule suoritti kokeen, jossa he pumppasivat kaasua tasaisella nopeudella lyijyputken läpi, josta syntyi rakenne. Ahtauman yläjuoksulla kaasu oli suuremmassa paineessa kuin ahtauman alajuoksulla. Myös kaasun lämpötilaa seurattiin tarkasti molemmin puolin rakennelmaa. Jäähtyminen, jonka he havaitsivat kaasun laajetessa korkeapaineiselta alueelta matalapaineiselle alueelle, oli erittäin tärkeää ja johti nykyaikaisten jääkaappien yhteiseen suunnitteluun.
kaikki kaasut eivät laajetessaan saa jäähdytysvaikutusta. Jotkin kaasut, kuten vety ja helium, kokevat lämpenevän vaikutuksen laajentuessaan olosuhteissa, jotka ovat lähellä huoneenlämpöä ja painetta. Lämpötilan muutoksen suunta voidaan määrittää mittaamalla Joule-Thomson-kerroin, \(\mu_{JT}\). Tämän kertoimen määritelmä on
\
kaavamaisesti Joule-Thomson-kerroin voidaan mitata mittaamalla lämpötilan lasku tai nousu, jonka kaasu läpäisee tietyn painehäviön aikana (Kuva \(\PageIndex{1}\)). Laite on eristetty niin, että lämpöä ei voida siirtää sisään tai ulos, jolloin laajennus onenthalpic.
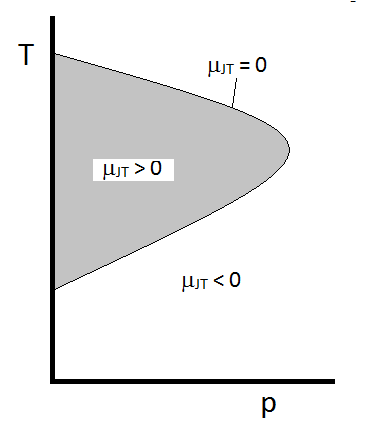
Joule-Thomson-kertoimen tyypillinen käyttäytyminen voidaan tiivistää kuvioon \(\PageIndex{2}\). \(T\) ja \(p\) yhdistelmissä, joille \(\mu_{JT} > 0\) (varjostetun alueen sisällä), näyte jäähtyy laajennettaessa. Niissä \(p\) ja \(t\) olosuhteissa varjostetun alueen ulkopuolella, joissa \(\mu_{jt} < 0\), kaasun lämpötila nousee laajetessaan. Ja pitkin rajaa, kaasu käy läpi eikä lämpötilan nousu ei vähene, kun laajeneminen. Tietylle paineelle on tyypillisesti kaksi lämpötilaa, joissa \(\mu_{JT}\) vaihtaa merkkiä. Nämä ovat ylempi ja alempi inversiolämpötila.
matematiikan työkalujen avulla on mahdollista ilmaista Joule-Thomson-kerroin mitattavina ominaisuuksina. Tarkastellaan entalpiaa paineen ja lämpötilan funktiona: \(h (p, T)\). Tämä viittaa siihen, että kokonaisdifferentiaali \(dH\) voidaan ilmaista
\
yksinkertainen substituutio osoittaa
\
niin
ideaalikaasulle\(\alpha = 1/T\), joten
\
, joka aiheuttaa ensimmäisen termin katoamisen. Joten jatkuvassa entalpian laajenemisessa (\(DH = 0\)) ei voi tapahtua lämpötilan muutosta (\(DT = 0\)). Tämä tarkoittaa, että kaasut näyttävät ei-nollan arvoja vain \(\mu_{JT}\) vain siksi, että ne poikkeavat ideaalisesta käyttäytymisestä!
esimerkki \(\PageIndex{1}\):
johdetaan \(\mu_{JT}\) lauseke \(\alpha\), \(C_p\), \(V\) ja \(t\).
ratkaisu
käyttäen \(H(p, t)\) kokonaisdifferentiaalia (yhtälö \ref{totalH}):
\
jakamalla \(dp\) ja rajoittamalla vakioon \(H\):
\
huomaten, että
\
\
\
\
\
ja
\
joten
\
\
\
\
\
, jotta saadaan
\
ja ratkaiseminen \ (\mu_{jt}\) antaa
\
avustajat ja attribuutit
-
Patrick E. Fleming (kemian ja Biokemian laitos; California State University, East Bay)