i 1852, der arbejdede med Vilhelm Thomson (som senere skulle blive Lord Kelvin), Joule gennemførte et eksperiment, hvor de pumpede gas med en jævn hastighed gennem et blyrør, der blev cinched for at skabe en konstruktion. På opstrømssiden af indsnævringen var gassen ved et højere tryk end på nedstrømssiden af indsnævringen. Også gasens temperatur blev omhyggeligt overvåget på begge sider af konstruktionen. Den afkøling, som de observerede, da gassen ekspanderede fra et højtryksområde til et lavere trykområde, var ekstremt vigtigt og førte til et fælles design af moderne køleskabe.
ikke alle gasser gennemgår en køleeffekt ved ekspansion. Nogle gasser, såsom brint og helium, vil opleve en opvarmningseffekt ved ekspansion under forhold nær stuetemperatur og tryk. Retningen for temperaturændring kan bestemmes ved at måle Joule-Thomson-koefficienten, \(\mu_{JT}\). Denne koefficient har definitionen
\
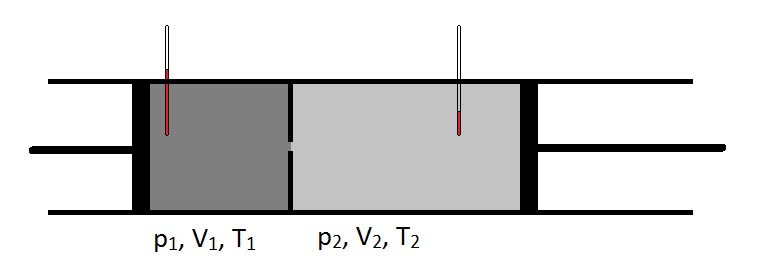
skematisk kan Joule-Thomson-koefficienten måles ved at måle temperaturfaldet eller øge en gas undergår for et givet trykfald (figur \(\Sideindeks{1}\)). Apparatet er isoleret, så ingen varme kan overføres ind eller ud, hvilket gør ekspansionen isenthalpisk.
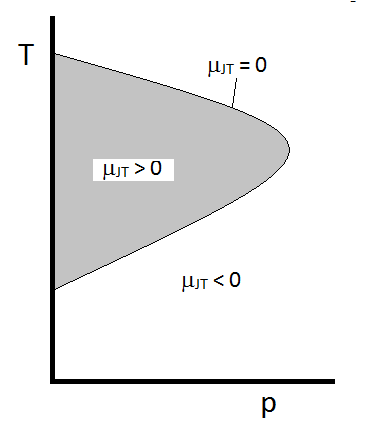
den typiske opførsel af Joule-Thomson-koefficienten kan opsummeres i figur \(\Sideindeks{2}\). Ved kombinationerne af \(T\) og \(p\) for hvilke \(\mu_{JT} > 0\) (inde i det skraverede område) afkøles prøven ved ekspansion. Ved disse \(p\) og \(T\) forhold uden for det skraverede område, hvor \(\mu_{JT} < 0\), vil gassen gennemgå en temperaturstigning ved ekspansion. Og langs grænsen vil en gas hverken gennemgå en temperaturstigning, der ikke falder ved ekspansion. For et givet tryk er der typisk to temperaturer, hvor \(\mu_{JT}\) ændrer tegn. Disse er de øvre og nedre inversionstemperaturer.
Ved hjælp af matematikens værktøjer er det muligt at udtrykke Joule-Thomson-koefficienten med hensyn til målbare egenskaber. Betragt entalpi som en funktion af tryk og temperatur: \(H(p, T)\). Dette antyder, at den samlede differential \(dH\) kan udtrykkes
\
det vil blive vist senere (igen, når vi udvikler de maksimale forhold), at
\
For en ideel gas,\(\alpha = 1/T\), så
\
for en ideel gas,\ (\alpha = 1/T\), så
\
hvilket får den første periode til at forsvinde. Så for konstant entalpiudvidelse (\(dH = 0\)) kan der ikke være nogen ændring i temperatur (\(dT = 0\)). Dette vil betyde, at gasser kun viser ikke-nulværdier for \(\mu_{JT}\) kun fordi de afviger fra ideel adfærd!
eksempel \(\Sideindeks{1}\):
udlede et udtryk for \(\mu_{JT}\) i form af \(\alpha\), \(C_p\), \(V\) og \(T\).
opløsning
brug af den samlede differential for \(H(p, T)\) (ligning \ref{totalH}):
\
dividere med \(dp\) og begrænsning til konstant \(H\):
\
og
\
så
\
Vi kan derefter bruge følgende substitutioner:
\
for at få
\
og løse for\(\mu_{jt}\) giver
\
bidragydere og tilskrivninger
-
Patrick E. Fleming (Institut for Kemi og biokemi; California State University, East Bay)