En 1852, trabajando con William Thomson (que más tarde se convertiría en Lord Kelvin), Joule llevó a cabo un experimento en el que bombeaban gas a una velocidad constante a través de un tubo de plomo que estaba ceñido para crear una construcción. En el lado aguas arriba de la constricción, el gas estaba a una presión más alta que en el lado aguas abajo de la constricción. Además, la temperatura del gas se monitorizó cuidadosamente a ambos lados de la construcción. El enfriamiento que observaron a medida que el gas se expandía de una región de alta presión a una región de baja presión fue extremadamente importante y condujo a un diseño común de refrigeradores modernos.
No todos los gases experimentan un efecto de enfriamiento al expandirse. Algunos gases, como el hidrógeno y el helio, experimentarán un efecto de calentamiento al expandirse en condiciones cercanas a la temperatura y la presión ambiente. La dirección del cambio de temperatura se puede determinar midiendo el coeficiente Joule-Thomson, \(\mu_{JT}\). Este coeficiente tiene la definición
\
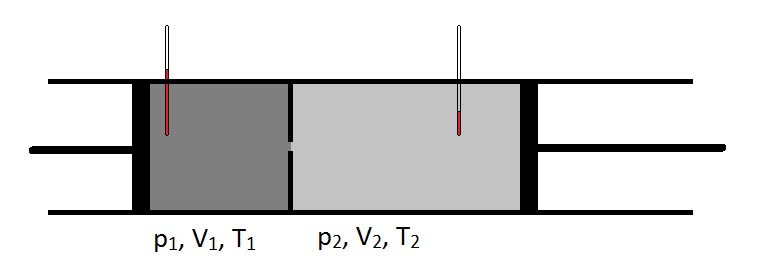
Esquemáticamente, el coeficiente Joule-Thomson se puede medir midiendo la caída de temperatura o el aumento que sufre un gas para una caída de presión dada (Figura \(\pageIndex{1}\)). El aparato está aislado para que no se pueda transferir calor hacia dentro o hacia fuera, haciendo que la expansión sea térmica.
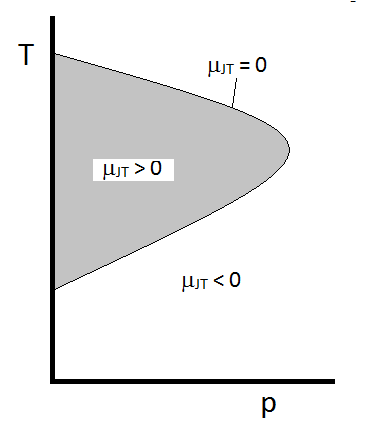
El comportamiento típico del coeficiente Joule-Thomson se puede resumir en Figure \(\pageIndex{2}\). En las combinaciones de \(T\) y \(p\) para las que \(\mu_{JT} > 0\) (dentro de la región sombreada), la muestra se enfriará al expandirse. En esas condiciones \(p\) y \(T\) fuera de la región sombreada, donde \(\mu_{JT} < 0\), el gas experimentará un aumento de temperatura al expandirse. Y a lo largo del límite, un gas no experimentará ni un aumento de temperatura ni una disminución al expandirse. Para una presión dada, normalmente hay dos temperaturas a las que \(\mu_{JT}\) cambia de signo. Estas son las temperaturas de inversión superior e inferior.
Utilizando las herramientas de las matemáticas, es posible expresar el coeficiente Joule-Thomson en términos de propiedades medibles. Considere la entalpía en función de la presión y la temperatura: \(H (p, T)\). Esto sugiere que el diferencial total \(dH\) se puede expresar
\
Se mostrará más adelante (de nuevo, una vez que desarrollemos las Relaciones de Maxwell) que
\
Una sustitución simple muestra
\
So
\
Para un gas ideal, \(\alpha = 1/T\), so
\
que hace que el primer término desaparezca. Por lo tanto, para una expansión de entalpía constante (\(dH = 0\)), no puede haber ningún cambio en la temperatura (\(dT = 0\)). Esto significa que los gases solo mostrarán valores distintos de cero para \(\mu_{JT}\) ¡solo porque se desvían del comportamiento ideal!
Ejemplo \(\pageIndex{1}\):
Derive una expresión para \(\mu_{JT}\) en términos de \(\alpha\), \(C_p\), \(V\) y \(T\).
Solución
el Uso de la diferencial total para \(H(p, T)\) (Ecuación \ref{totalH}):
\
Dividiendo por \(dp\) y se limita a la constante \(H\):
\
al Señalar que
\
\
y
\
así
\
a continuación, podemos utilizar las siguientes sustituciones:
\
\
\
Para
\
Y de la solución para que \(\mu_{JT}\) da
\
los Contribuyentes y Atribuciones
-
Patrick E. Fleming (Departamento de Química y Bioquímica; California State University, East Bay)