Em 1852, trabalhando com William Thomson (que mais tarde se tornaria Lord Kelvin), Joule realizou um experimento em que eles gás bombeado a uma taxa constante através de um tubo de chumbo, que foi composta para criar uma construção. No lado a montante da constrição, o gás estava a uma pressão mais elevada do que no lado a jusante da constrição. Além disso, a temperatura do gás foi cuidadosamente monitorada em ambos os lados da construção. O resfriamento que eles observaram quando o gás se expandiu de uma região de alta pressão para uma região de baixa pressão foi extremamente importante e levou a um projeto comum de frigoríficos modernos.nem todos os gases sofrem um efeito de arrefecimento após a expansão. Alguns gases, como hidrogênio e hélio, experimentarão um efeito de aquecimento sobre a expansão em condições próximas à temperatura ambiente e à pressão. A direção da mudança de temperatura pode ser determinada pela medição do coeficiente Joule-Thomson, \(\mu_{JT}\). Este coeficiente tem a definição
\
esquematicamente, o coeficiente de Joule-Thomson pode ser medido medindo a queda de temperatura ou aumentando um gás sujeito a uma dada queda de pressão (figura \(\PageIndex{1}\)). O aparelho é isolado de modo a que nenhum calor possa ser transferido para dentro ou para fora, tornando a expansão isentálpica.
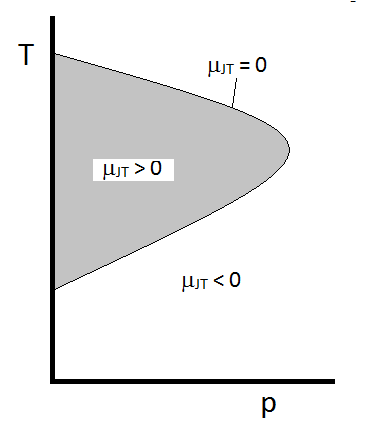
O comportamento típico de Joule-Thomson coeficiente pode ser resumido na Figura \(\PageIndex{2}\). No combinações de \(T\) e \(p\) para que \(\mu_{JT} > 0\) (dentro da região sombreada), a amostra legal após a expansão. Nas condições \(p\) E \(T\) fora da região sombreada, onde \(\mu_{JT} < 0\), o gás sofrerá um aumento de temperatura após a expansão. E ao longo da fronteira, um gás não sofrerá nem um aumento de temperatura não diminuirá com a expansão. Para uma dada pressão, existem normalmente duas temperaturas a que \(\mu_{JT}\) muda o sinal. Estas são as temperaturas de inversão superior e inferior.
Usando as ferramentas da matemática, é possível expressar o coeficiente de Joule-Thomson em termos de propriedades mensuráveis. Considere a entalpia como uma função de pressão e temperatura: \(H(p, T)\). Isto sugere que o total de diferencial \(dH\) pode ser expresso
\
Ele será mostrado mais tarde (de novo, uma vez que se desenvolvem as Relações de Maxwell) que
\
Uma simples substituição mostra
\
Assim
\
Para um gás ideal, \(\alpha = 1/T\), então
\
o que faz com que o primeiro termo a desaparecer. Assim, para a expansão de entalpia constante (\(dH = 0\)), não pode haver alteração na temperatura (\(dT = 0\)). Isto significa que os gases só irão mostrar valores não-zero para \(\mu_{JT}\) apenas porque se desviam do comportamento ideal!
exemplo \(\PageIndex{1}\):
Derivar uma expressão para \(\mu_{JT}\) em termos de \(\alpha\), \(C_p\), \(V\) e \(T\).
Solução
Usando a total diferencial de \(H(p, T)\) (Equação \ref{totalH}):
\
Dividir por \(dp\) e restringindo a constante de \(H\):
\
Notar que
\
\
e
\
assim
\
em seguida, podemos usar as seguintes substituições:
\
\
\
Para obter
\
E resolução de problemas para \(\mu_{JT}\) dá
\
Colaboradores e Atribuições
-
Patrick E. Fleming (Department of Chemistry and Biochemistry; California State University, East Bay)