w 1852 roku, pracując z Williamem Thomsonem (który później stał się Lordem Kelvinem), Joule przeprowadził eksperyment, w którym pompowali gaz ze stałą prędkością przez ołowianą rurę, która została zaciśnięta w celu stworzenia konstrukcji. Po stronie upstream zwężenia Gaz znajdował się pod wyższym ciśnieniem niż po stronie downstream zwężenia. Również temperatura gazu była dokładnie monitorowana po obu stronach konstrukcji. Chłodzenie, które obserwowali, gdy gaz rozszerzał się z regionu wysokiego ciśnienia do regionu niskiego ciśnienia, było niezwykle ważne i doprowadziło do wspólnej konstrukcji nowoczesnych lodówek.
nie wszystkie gazy ulegają efektowi chłodzenia przy rozprężaniu. Niektóre gazy, takie jak wodór i hel, doświadczają efektu ocieplenia przy rozszerzaniu w warunkach zbliżonych do temperatury pokojowej i ciśnienia. Kierunek zmian temperatury można określić mierząc współczynnik Joule ’ a-Thomsona, \(\mu_{JT}\). Współczynnik ten ma definicję
\
schematycznie współczynnik Joule ’ a-Thomsona można zmierzyć mierząc spadek temperatury lub wzrost gazu podlegającego danemu spadkowi ciśnienia (rysunek \(\PageIndex{1}\)). Urządzenie jest izolowane tak, że nie można przenosić ciepła do środka lub na zewnątrz, dzięki czemu ekspansja jest entalpiczna.
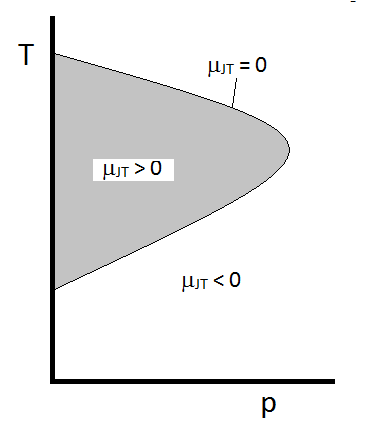
typowe zachowanie współczynnika Joule ’ a-Thomsona można podsumować na rysunku \(\PageIndex{2}\). W kombinacjach \(T\) I \(p\), dla których \(\mu_{JT} > 0\) (wewnątrz zacienionego obszaru) próbka ostygnie po rozszerzeniu. W tych warunkach \(p\) i \(T\) poza obszarem zacienionym, gdzie \(\mu_{JT} < 0\), Gaz ulegnie wzrostowi temperatury po rozprężeniu. A wzdłuż granicy gaz nie ulegnie ani wzrostowi temperatury, ani spadkowi po rozprężeniu. Dla danego ciśnienia występują zazwyczaj dwie temperatury, przy których\ (\mu_{JT}\) zmienia znak. Są to górne i dolne temperatury inwersji.
za pomocą narzędzi matematycznych można wyrazić współczynnik Joule ’ a-Thomsona w kategoriach właściwości mierzalnych. Rozważmy entalpię jako funkcję ciśnienia i temperatury: \(H (p, T)\). To sugeruje, że całkowita różnica \(dH\) może być wyrażona
\
zostanie pokazana później (ponownie, gdy rozwiniemy relacje Maxwella), że
\
proste podstawienie pokazuje
\
więc
\
dla gazu idealnego, \(\alpha = 1/t\), więc
\
co powoduje zanik pierwszego terminu. Tak więc dla stałej ekspansji entalpii (\(DH = 0\)) nie może być żadnych zmian temperatury (\(dT = 0\)). Oznacza to, że gazy będą pokazywać wartości niezerowe tylko dla \(\mu_{JT}\) tylko dlatego, że odbiegają od idealnego zachowania!
przykład \(\PageIndex{1}\):
wyprowadza wyrażenie dla \(\mu_{JT}\) w kategoriach \(\alpha\), \(C_p\), \(V\) i \(T\).
rozwiązanie
używając różniczki całkowitej dla \(H(P, T)\) (równanie \ref{totalH}):
\
dzieląc przez \(dp\) i ograniczając do stałej \(H\):
\
\
i
\
więc
\
możemy wtedy użyć następujących podstawień:
\
\
\
aby uzyskać
\
i rozwiązując dla\(\mu_{JT}\) daje
\
współpracowników i atrybutów
-
Patryk E. Fleming (Wydział Chemii i biochemii; California State University, East Bay)