1852-ben William Thomsonnal (aki később Lord Kelvin lesz) együttműködve Joule kísérletet végzett, amelynek során állandó sebességgel pumpáltak gázt egy ólomcsövön keresztül, amelyet egy konstrukció létrehozásához rögzítettek. A szűkület upstream oldalán a gáz nagyobb nyomáson volt, mint a szűkület downstream oldalán. A gáz hőmérsékletét a szerkezet mindkét oldalán gondosan ellenőrizték. A hűtés, amelyet megfigyeltek, amikor a gáz nagynyomású tartományból alacsonyabb nyomású tartományba bővült, rendkívül fontos volt, és a modern hűtőszekrények közös tervezéséhez vezetett.
nem minden gáznak van hűtő hatása a táguláskor. Egyes gázok, mint például a hidrogén és a hélium, melegítő hatást fognak tapasztalni, ha szobahőmérséklet és nyomás közelében tágulnak. A hőmérsékletváltozás irányát a Joule-Thomson együttható, \(\mu_{JT}\) mérésével lehet meghatározni. Ennek az együtthatónak a meghatározása
\
vázlatosan a Joule-Thomson együttható mérhető a hőmérséklet csökkenésének mérésével vagy a gáz adott nyomásesésnél történő növelésével (\(\PageIndex{1}\) ábra). A készüléket úgy szigetelik, hogy ne kerüljön hő be vagy ki, így a tágulás izenthalpikus.
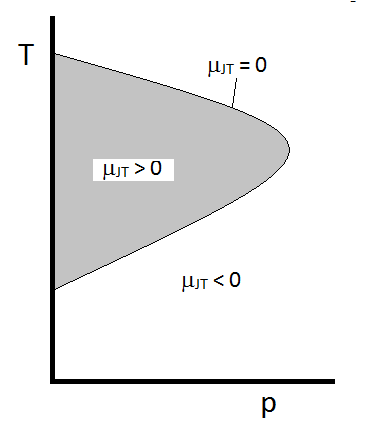
a Joule-Thomson együttható tipikus viselkedését a \(\PageIndex{2 ábra foglalja össze}\). A \(T\) és \(p\) kombinációknál, amelyeknél \(\mu_{JT} > 0\) (az árnyékolt területen belül) a minta hűlni fog a bővítéskor. Azokban a\ (p\) és\ (T\) körülmények között az árnyékolt régión kívül, ahol \(\mu_{JT} < 0\), a gáz táguláskor hőmérséklet-emelkedésen megy keresztül. És a határ mentén, a gáz megy keresztül sem a hőmérséklet-emelkedés nem csökken a terjeszkedés. Egy adott nyomáshoz általában két hőmérséklet van, amelyeken\ (\mu_{JT}\) megváltoztatja a jelet. Ezek a felső és az alsó inverziós hőmérsékletek.
a matematika eszközeivel a Joule-Thomson együtthatót mérhető tulajdonságokkal lehet kifejezni. Tekintsük az entalpiát a nyomás és a hőmérséklet függvényében: \(H (p, T)\). Ez azt sugallja, hogy a teljes differenciál \(dH\) kifejezhető
\
később (ismét, miután kifejlesztettük a Maxwell-kapcsolatokat), hogy
\
egy egyszerű helyettesítés azt mutatja, hogy
\
So
\
egy ideális gáz esetében, \(\alpha = 1/T\), tehát
\
ami az első kifejezés eltűnését okozza. Tehát állandó entalpia expanzió esetén (\(dH = 0\)) a hőmérséklet nem változhat (\(dT = 0\)). Ez azt jelenti, hogy a gázok csak nem nulla értékeket mutatnak \(\mu_{JT}\) csak azért, mert eltérnek az ideális viselkedéstől!
példa \(\PageIndex{1}\):
a \(\mu_{JT}\) kifejezés származtatása \(\alpha\), \(C_p\), \(V\) és \(T\) kifejezésekkel.
megoldás
a teljes differenciálmű használata a \(H(p, T)\) (egyenlet \ref{totalH}):
\
osztjuk \(dp\) – vel és korlátozzuk állandóra \(H\):
\
megjegyezve, hogy
\
\
\
és
\
\
tehát
\
ezután a következő helyettesítéseket használhatjuk:
\
\
\
és a \(\mu_{JT}\) megoldása
\
közreműködők és attribútumok
-
Patrick E. Fleming (kémiai és Biokémiai Tanszék; Kaliforniai Állami Egyetem, East Bay)